


如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
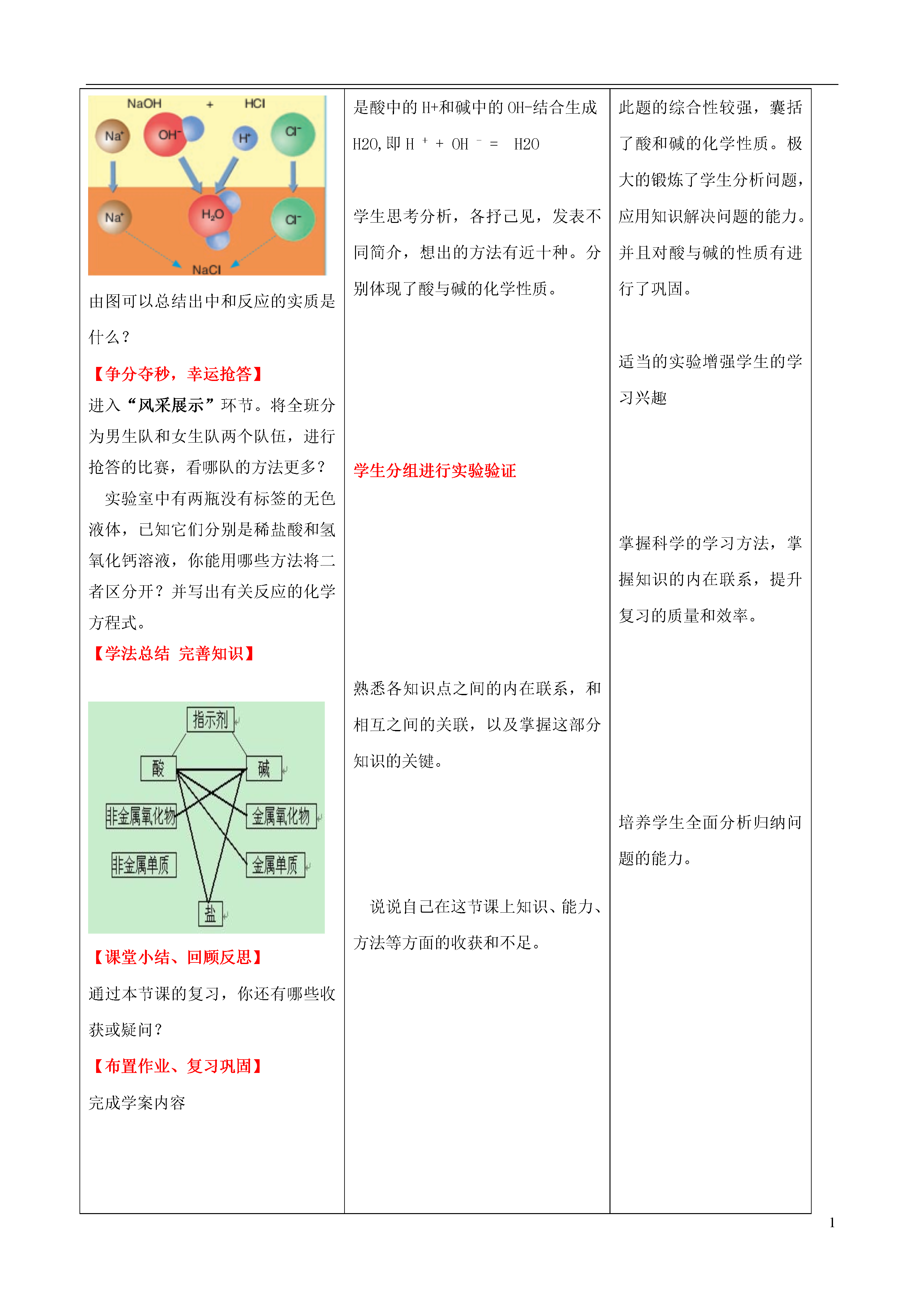
1课题:第七单元常见的酸和碱单元复习一、学情分析在新课讲授的过程中,学生对酸和碱的有关知识已有了基本了解,但还没能系统掌握酸和碱的化学性质,特别是对酸和碱中常见实验探究题的认识,学生还没有一个清晰的思路。另一方面学生对酸和碱的“化学生活化,化学社会化”还没有较深的体会,通过本节课的复习旨在一方面让学生系统掌握酸和碱的化学性质;另一方面能够更好地运用化学知识解决生产生活中的实际问题。二、复习的总体设想本单元主要包括两部分内容:一是常见酸碱的有关知识,二是酸碱度的表示方法和中和反应的有关知识。酸碱的相关知识,特别是常见酸碱的化学性质是考试的常考点,也是生活中经常会遇到的问题,是化学下册的一大重点知识,学生应该把酸碱知识结合进行综合性复习,联系化学生活化,化学社会化。为此我设计了如下的教学思路:三、复习目标◆知识与技能:(1)通过复习酸和碱的组成与结构、性质与变化,了解酸的通性,能认识到酸的性质实质就是H+的性质,碱的性质就是OH_的性质。(2)归纳出酸、碱的化学性质(3)进一步了解中和反应的特点、理解中和反应的实质以及书写化学方程式规律。◆过程与方法1.通过对常见化学方程式的书写,引导学生归纳总结规律。2.通过对酸碱性质的归纳培养学生的求同能力。◆情感态度与价值观1.增强学生的合作学习的意识。2.培养学生认真细致的学习态度,帮助学生养成严谨务实的生活态度。3.通过学生运用所学的知识解决实际问题,进一步激发学习化学的兴趣。教学重点1、酸和碱的化学性质。2、中和反应的实质。教学难点酸和碱的化学性质以及中和反应实质的归纳整理四、教学方法分析讨论、归纳总结五、教学流程设计:创设情景,引入新课复习酸的化学性质微观看酸,理解酸的实质复习碱的化学性质回顾浓硫酸和浓盐酸的特性微观看碱,理解碱的实质复习氢氧化钠氢氧化钙的物理性质中和反应理解中和反应的实质抢答练习巩固知识学法总结完善知识课堂小结、回顾与反思六、教学过程教师活动学生活动设计意图【创设情景、引入新课】枣庄某地一化工厂排放的废水流入峄城大沙河中,环保局监测发现废水呈酸性没有达到排放要求,勒令其处理后再排放。现有一瓶取回的废水水样,请你设计几套不同的方案,证明这瓶水呈酸性。【微观看酸知识升华】酸的实质是什么?H2SO4H2SO4SO42+H2SO4SO42+SO42+【补充知识,注重完整】对于浓盐酸、浓稀硫酸,你了解它们的特性吗?【触类旁通,举一反三】如果废水呈碱性,经检测废水的碱性是熟石灰引起的,请同学们写出设计方案中有关化学方程式【微观看碱知识升华】碱的实质是什么?【补充知识,注重完整】氢氧化钠和氢氧化钙有哪些物理性质?酸与碱的反应是什么反应?盐酸与氢氧化钠反应的实质是什么?【微观看实质知识再升华】由图可以总结出中和反应的实质是什么?【争分夺秒,幸运抢答】进入“风采展示”环节。将全班分为男生队和女生队两个队伍,进行抢答的比赛,看哪队的方法更多?实验室中有两瓶没有标签的无色液体,已知它们分别是稀盐酸和氢氧化钙溶液,你能用哪些方法将二者区分开?并写出有关反应的化学方程式。【学法总结完善知识】【课堂小结、回顾反思】通过本节课的复习,你还有哪些收获或疑问?【布置作业、复习巩固】完成学案内容观察、思考如果废水中的酸是盐酸或硫酸,请你写出实验中涉及的有关化学方程式。讨论总结出实验方案紫色石蕊试液PH试纸金属如铁、镁等Fe+H2SO4=FeSO4+H2↑④金属氧化物Fe2O3+6HCl=2FeCl3+3H2O⑤某些碱如氢氧化铜、氢氧化铁Cu(OH)2+H2SO4=CuSO4+2H2O⑥某些盐如CaCO3+2HCl=CaCl2+H2O+CO2。学生观察图片,思考总结出酸溶液中都有自由移动的H+,酸的化学性质其实就是H+的化学性质。思考、讨论、总结浓盐酸浓硫酸化学式HClH2SO4颜色状态无色液体无色粘稠油状液体打开瓶盖后的现象产生白雾无明显现象气味刺激性气味无气味挥发性有挥发性不易挥发与水混合无明显现象放出大量的热其它腐蚀性腐蚀性吸水性脱水性思考、讨论、总结出实验方案紫色石蕊试液PH试纸1.某些盐如CuCl2、FeCl3Ca(OH)2+CuCl2=Cu(OH)2↓+CaCl22.某些非金属氧化物如CO2Ca(OH)2+CO2=CaCO3+H2O3.碱和酸(借助指示剂)Ca(OH)2+H2SO4=CaSO4+2H2O学生观察图片,思考总结出碱溶液中都有自由移动的OH-,碱的化学性质其

邻家****ng
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















