课件-全国-2018_(泰安专版)2018中考化学总复习 第一部分 系统复习 成绩基石 第6讲 定量研究化学反应课件.ppt
 立即下载
立即下载




如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
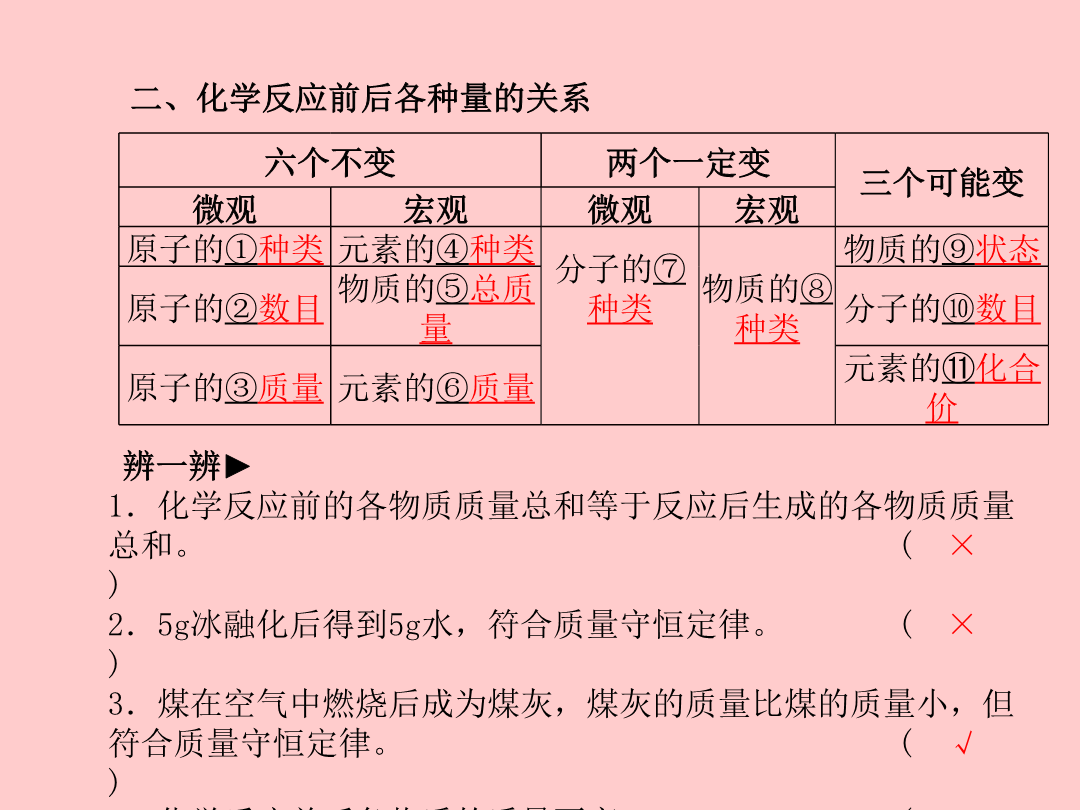
第一部分系统复习成绩基石第6讲定量研究化学反应考点梳理过关二、化学反应前后各种量的关系考点2化学方程式6年5考三、化学方程式的书写考点3利用化学方程式的简单计算6年4考想一想►根据化学方程式的计算过程中需要注意哪些问题?①设未知量时不能带单位;②写准物质化学式;③化学方程要配平;④相对分子质量写在反应物的正下方,计算中需要的才写,不需要的不写;⑤已知量、未知量的单位要统一;⑥关系式对关系量,计算单位不能忘;⑦关系量间成正比,解设比答要完整。典型例题运用解题方法►解此类题目可分三步第一步:未知物质质量的测定。根据反应前后物质的总质量不变列出等式,求出未知物质的质量。第二步:反应物、生成物、催化剂的判定。反应后质量增加——生成物;反应后质量减少——反应物;质量不变——可能是催化剂,也可能是未参加反应的物质。第三步:根据反应物、生成物种类及反应特点判断反应类型等其他信息的正误。变式运用►1.[2016·怀化中考]将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如下表:C由表格信息可知,反应后a的质量增加了10g-6.4g=3.6g,是生成物,b的质量减少了14g-7.2g=6.8g,是反应物,A错误;根据质量守恒定律,6.4+14+3.2+1=10+7.2+x+1,故x=6.4,B错误;反应后c的质量增加了6.4g-3.2g=3.2g,为生成物,所以此反应中反应物是b,生成物是a、c,符合“一变多”的特点,属于分解反应,C正确;d质量不变,作催化剂或者是杂质,D错误。2.[2017·呼和浩特中考]下图表示某化学反应的微观示意图,依据图分析判断,下列说法正确的是()C由图知,甲为SiCl4,乙为H2,丙为Si,丁为HCl,即该反应为SiCl4+2H2一定条件(=====)Si+4HCl。甲物质由SiCl4分子构成,每个SiCl4分子由1个Si原子和4个Cl原子构成,A错误;在该反应前后,Si元素化合价由+4价变为0价,B错误;由化学反应中的元素守恒可知,参加反应的氢气的质量等于反应后生成氯化氢中氢元素的质量,C正确;在该反应中,参加反应的甲、乙两种物质的分子个数比为1∶2,D错误。类型2化学方程式变式运用►3.[2016·泸州中考]下列反应的化学方程式正确的是()A.石灰水长期存放后产生的白膜用硝酸清洗:Ca(OH)2+HNO3===CaNO3+2H2OB.硫酸铵与烧碱混合:NH4SO4+NaOH===NaSO4+H2O+NH3↑C.制取铝:3Zn+Al2(SO4)3===3ZnSO4+2AlD.铜表面的铜绿[Cu2(OH)2CO3]用盐酸除去:Cu2(OH)2CO3+4HCl===2CuCl2+3H2O+CO2↑类型3利用化学方程式的简单计算(1)该混合物中硫酸钠的质量分数为15g(14.2g)×100%≈94.7%(2)反应后所得滤液中氯化钠的质量为11.7g+(15g-14.2g)=12.5g,反应后所得滤液中溶质的质量分数为271.7g(12.5g)×100%≈4.6%答:(1)该混合物中硫酸钠的质量分数是94.7%;(2)反应后所得滤液中溶质的质量分数是4.6%。解题方法►对于利用化学方程式计算的试题,首先进行信息梳理:(1)明确需要求的量;(2)分析、选用计算公式;(3)确定需要知道的量;(4)根据未知量设未知数,然后写出化学方程式,根据已知条件利用化学方程式找出相关物质的关系列比例求解即可。注意事项►计算反应后溶质的质量时一定要确定杂质是否已经转化成了溶质;计算反应后溶液的质量时要确定杂质是否已经溶解。变式运用►4.实验中学化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。请根据以上信息计算:(1)样品中碳酸钙的质量分数;(2)C烧杯中溶液的溶质质量分数。(1)样品中碳酸钙的质量分数为25g(20g)×100%=80%(2)C烧杯中溶液的溶质质量分数为20g+100g+110.8g-8.8g(22.2g)×100%=10%答:(1)样品中碳酸钙的质量分数为80%;(2)C烧杯中溶液的溶质质量分数为10%。实验聚焦突破特别提醒►白磷燃烧实验中气球形状变化的原因:由于白磷燃烧放出热量,使锥形瓶内气体温度升高,瓶内压强增大,所以气球⑨__鼓起来__;又因为白磷燃烧消耗⑩__氧气__,使瓶内气体减少,瓶内压强减小,所以气球变小,冷却后,瓶内压强⑪__小于__大气压强,所以气球变得比白磷燃烧前更瘪。气球的作用:一是调节锥形瓶内的压强,起缓冲作用;二是起⑫__密封__作用,防止实验时锥形瓶内外发生气体交换。典例分析(1)在实验Ⅰ中,反应后的质量比反应前明显增加,请用质量守恒定律加以解释

春兰****89
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















