


如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
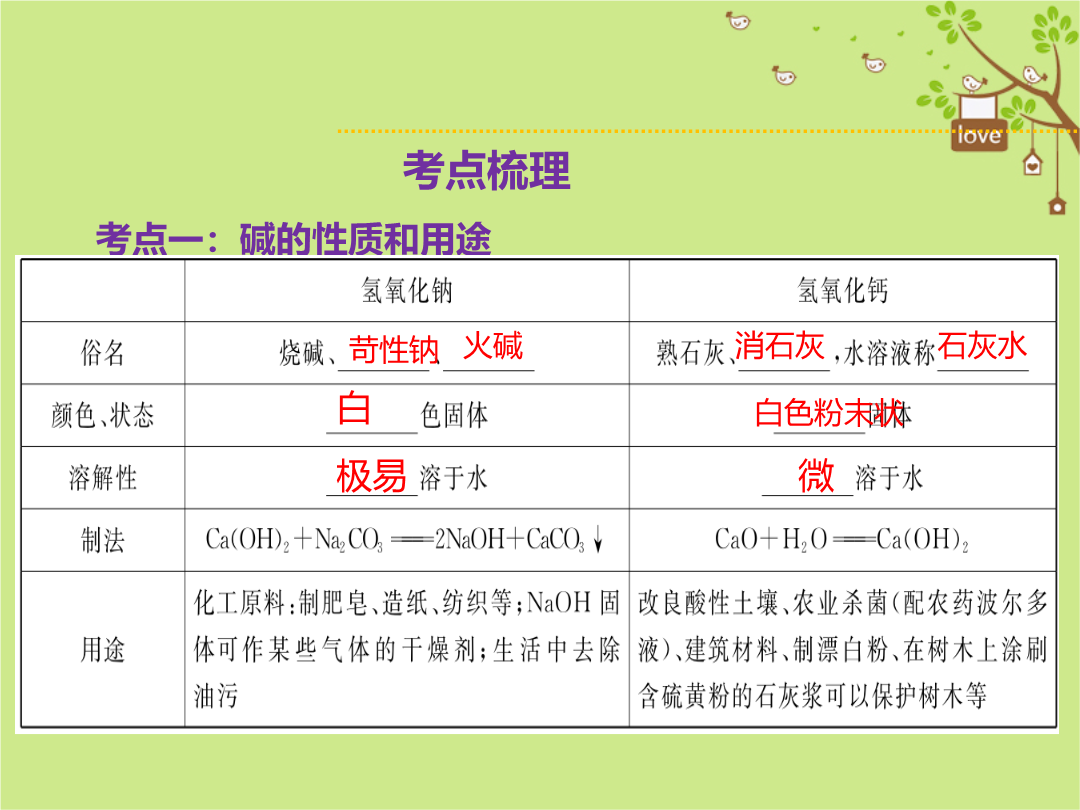
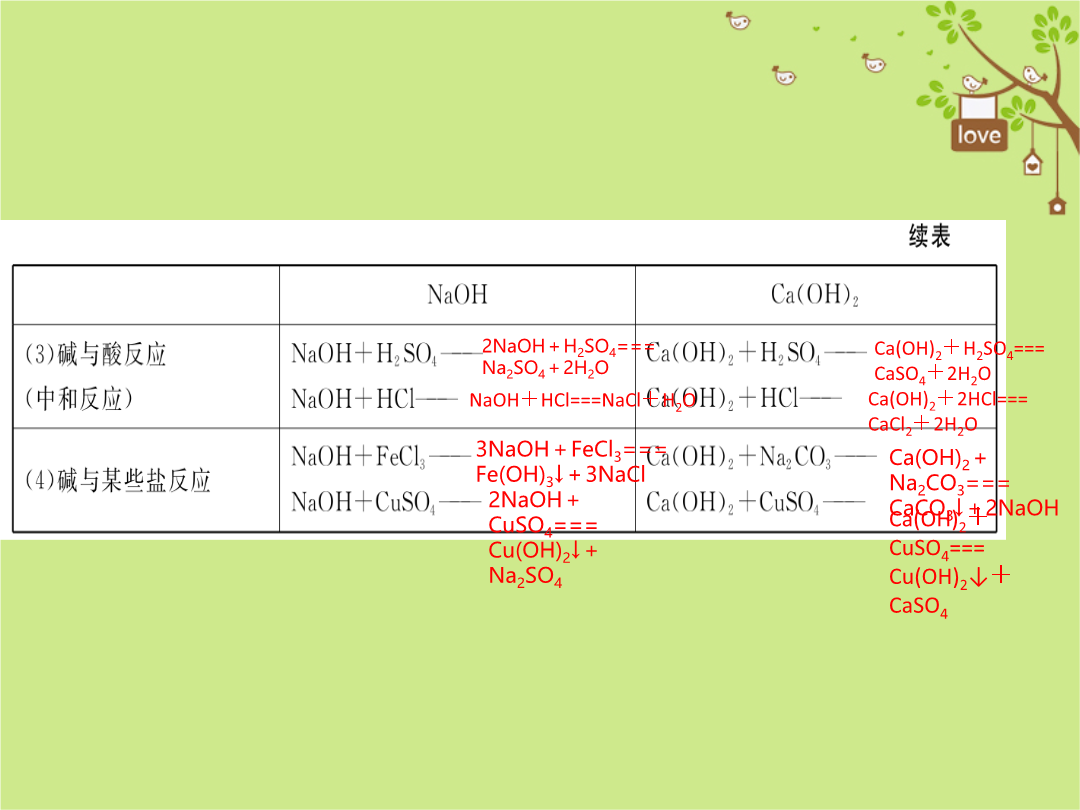
考点梳理考点一:碱的性质和用途温馨提示►①有关干燥剂的选择原则:干燥剂与被干燥的气体不发生化学反应。如浓硫酸可干燥O2、N2、CO2、H2、HCl等气体,但不能干燥NH3(碱性气体);NaOH固体可干燥O2、N2、H2、NH3等气体,但不能干燥CO2、SO2、HCl等酸性气体。②改良酸性土壤不能用NaOH,因为它有强烈的腐蚀性。③强碱沾在皮肤上的事故处理方法:立刻用大量的水冲洗,然后涂上硼酸溶液。④氢氧化钠敞口放置于空气中会吸水发生潮解(物理性质),与CO2发生反应而变质(化学性质),使质量增大,因此必须密封保存。⑤NaOH固体、CaO溶于水会放热,Ca(OH)2溶于水不放热。2.碱的化学性质(视频链接:酸碱指示剂、中和反应、生石灰与水反应等)碱有相似的化学性质,是因为它们溶于水后产生的阴离子全部都是________。2NaOH+H2SO4===Na2SO4+2H2O温馨提示►①酸和碱作用,生成盐和水的反应叫中和反应。②中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。如:CuO+H2SO4===CuSO4+H2O、CO2+2NaOH===Na2CO3+H2O都不是中和反应。③中和反应一定是复分解反应,但复分解反应不一定是中和反应。④中和反应的应用:土壤显酸性,可以用________来调节;工厂排出的废水含有硫酸可以用________等碱性物质来中和;胃酸过多的病人,可以服用________来中和过多的胃酸,反应的化学方程式是________________________________。考点二:溶液的酸碱度(2)测定溶液pH最简便的方法是________。测定时,用________蘸取待测液滴在________上,立即把试纸显示的颜色与标准比色卡对照,颜色最为接近的即为pH。(3)改变溶液pH的方法:①使溶液的pH升高,应加水或碱性溶液;②使溶液的pH降低,应加________。温馨提示►①测定溶液的pH,不能将pH试纸浸入待测液中,不能把待测液倒在pH试纸上,也不能先用水将pH试纸湿润,否则会影响实验结果。若先用水将pH试纸湿润,若为中性溶液,结果无影响;若为酸性溶液,pH会偏大;若为碱性溶液,pH会偏小。②酸溶液一定呈酸性(pH<7),但酸性溶液(pH<7的溶液)不一定是酸溶液,部分盐溶液也呈酸性,如硫酸铜溶液;碱溶液一定呈碱性(pH>7),但碱性溶液(pH>7的溶液)不一定是碱溶液,部分盐溶液也呈碱性,如碳酸钠溶液、草木灰水(含碳酸钾)。温馨提示►③用pH试纸只能粗略测定溶液的pH为0~14的整数值,如pH=5.6,pH=8.3等则无法用pH试纸测出;用酸度计(pH计)则可以精确到小数点后1位或几位。④正常雨水中溶解了空气中的CO2而略显酸性,正常雨水的pH≈5.6,当雨水的pH<5.6时称为酸雨。重点实验:酸、碱的化学性质溶解红难点突破(2)乙同学对甲同学的结论提出了质疑,并对反应后溶液中的溶质成分进行探究。【实验探究】反应后溶液中的溶质是什么?猜想一:只有NaCl;猜想二:NaCl和HCl;猜想三:NaCl和NaOH。以上猜想中,你觉得不合理的是____________。为了验证另外两种猜想,乙同学设计如下实验方案:【易错点剖析】氢氧化钠溶液显碱性,能使酚酞变红色,滴入一定量的稀盐酸后,溶液为无色,甲同学得出两者恰好中和的结论,反应的化学方程式为:NaOH+HCl===NaCl+H2O;对反应后溶液中溶质成分的判断,生成物一定有,反应物可能有,由于溶液为无色,说明一定不含NaOH,故猜想三不合理;故要证明其余两种猜想,实际就是证明是否含有HCl,如不含有,则猜想一正确,若含有,则猜想二正确,故根据盐酸的化学性质,取少量反应后的溶液于试管中滴入Na2CO3溶液,实验现象:有气泡产生,则证明猜想二成立。酸与可溶性碱的中和反应一般都没有明显现象,需要借助指示剂变色或pH试纸显示溶液酸碱性的变化。对反应过程中,对反应后溶液中溶质成分的判断在中考中属于重点,分三种情况讨论:①酸碱恰好完全反应时,溶质为可溶性生成物;②酸过量,碱不足时,溶质为可溶性生成物和过量的酸;③碱过量,酸不足时,溶质为可溶性生成物和过量的碱。同类变式:某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。Ⅰ.写出该中和反应的化学方程式:________________。Ⅱ.探究烧杯内溶液中溶质的成分。【提出问题】该烧杯内溶液中的溶质是什么?【猜想】猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;猜想三:____________。【查阅

羽沫****魔王
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















