



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
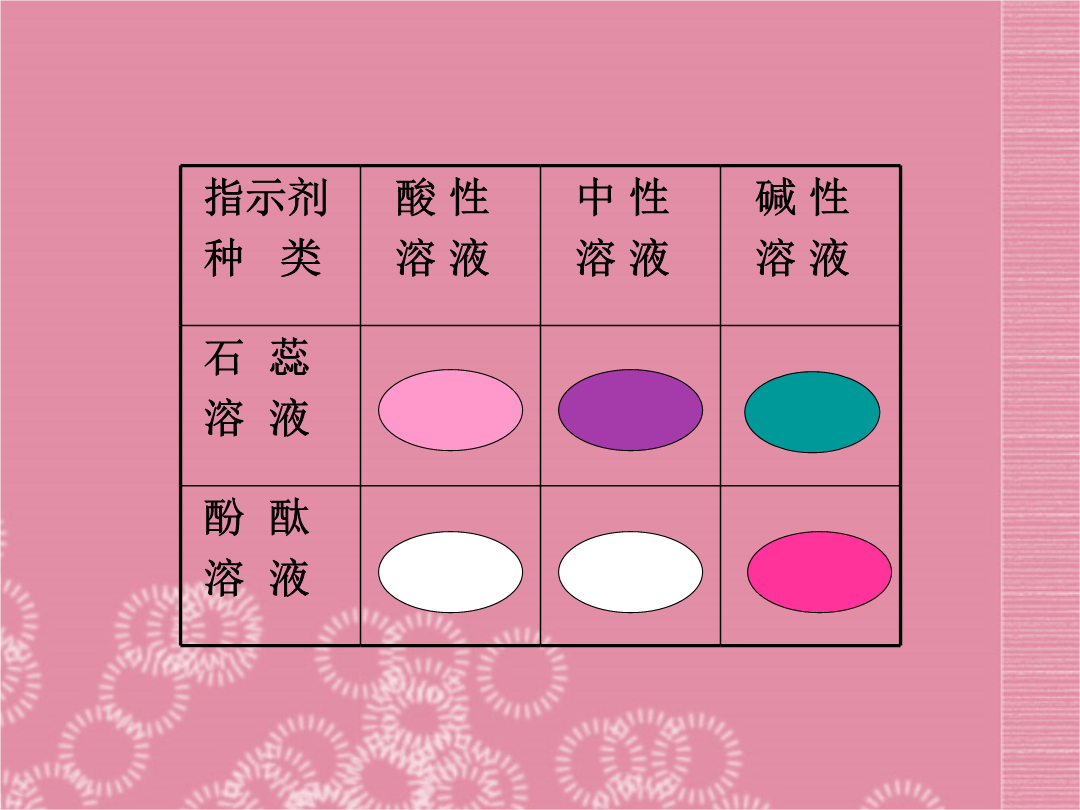
课题1常见的酸和碱1、人的胃液里含有盐酸();2、汽车电瓶里含有硫酸();3、食醋里含有醋酸(),也叫乙酸;4、酸雨里含有亚硫酸(),也可能含有硝酸()。注意:酸碱指示剂与酸或碱的溶液反应时,变色的是指示剂,而不是酸碱。敞口放置的浓硫酸和浓盐酸,一段时间后,溶质的质量分数将如何变化?原因是什么,试分析?2.浓硫酸的特性:(1)吸水性:能吸收空气及其他物质中的水分,使硫酸变稀。(2)腐蚀性:能夺取纸张、木材、棉布、皮肤(由含C、H、O等元素的化合物组成)里的水分,生成黑色的炭。(脱水性)我入水中较安全;水入我中真危险。我与水合多放热;实验牢记保平安。打一实验操作通过前面的学习我们已经知道,酸可以跟许多物质发生反应,这些反应在生产、生活和科学研究中应用广泛。如某些工厂常用稀硫酸清洗金属器件,就是利用酸与金属氧化物的反应。你还知道酸与哪些物质能发生反应?请将你所知道的与同学们交流、讨论。1、与指示剂作用酸溶液能使紫色石蕊试液变红色无色酚酞试液不变色结论:镁、铝、锌、铁等活动性较强的金属都能与稀硫酸、盐酸发生置换反应,放出氢气,同时生成一种称为盐的化合物。3、金属氧化物与酸的反应4、酸与碱反应(与Cu(OH)2Fe(OH)3)的反应石灰石的主要成分是什么?请写出稀盐酸与石灰石的主要成分反应的化学方程式。小组讨论:盐酸、硫酸在组成和性质上有许多共同之处。请你尽可能多地归纳出它们的共同点,并与同学们交流。探究:稀硫酸和稀盐酸的化学性质1.完成下列反应方程式,并指明反应类型。Fe+HCl=Zn+=ZnSO4++=Fe2(SO4)3+H2OCaCO3+=CaCl2++KMnO4=+MnO2+SO2+H2O=H2O2=+C02+H2O=2.下列各物质露置在空气中,一段时间后,物质的总质量会增加的是()A.浓盐酸B.浓硝酸C.浓硫酸D.醋酸3.相同质量的下列金属与足量的等质量的相同质量分数的稀硫酸反应,产生氢气质量最多的是()A.ZnB.FeC.MgD.Al4.下列物质不能与锌发生置换反应生成氢气的是()A.稀硫酸B.盐酸C.硝酸D.浓硫酸D总结:不同酸所具有的共同特点及原因:(1)酸与酸碱指示剂的反应A.紫色石蕊试液或蓝色石蕊试纸遇到酸溶液变红色;B.无色酚酞试剂遇到酸溶液不变色。提醒:紫色石蕊试剂变色情况为:“酸红碱蓝”;是指示剂变色,而非待测溶液本身变色。(2)酸与某些金属反应酸溶液+活动性较强的金属→盐溶液+氢气注意:A.在金属活动性顺序表中,排在氢前面的金属能置换出酸中的氢,排在氢后面的金属则不能;B.排在金属活动性顺序表越前面的金属,反应现象越剧烈,速度越快,如Mg反应有明显放热现象;C.强氧化性酸与金属反应后,不能生成氢气,而是生成水。如浓硫酸、硝酸等强氧化性酸;D.该类反应属于置换反应(3)酸与某些金属氧化物反应酸+金属氧化物→盐溶液+水注意:该反应过程中,金属元素的化合价不变,酸中的原子团不变Fe2O3+3H2SO4==Fe2(SO4)3+3H2OFe2O3+6HCl==2FeCl3+3H2O(5)酸与某些盐反应酸+盐→新酸+新盐我们通常遇到的盐是碳酸盐,因此绝大部分反应是:酸+碳酸盐→新盐+水+二氧化碳称取铜、锌混合物粉末10.0g置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时用去49.0g稀硫酸。剩余固体3.5g。⑴该混合物粉末中铜的质量分数为多少?⑵所用的稀硫酸溶质的质量分数是多少?课外作业(计算):将一定量的石灰石放入烧杯中,加入100g稀盐酸恰好完全反应(杂质不溶解,也不参加反应),此时,烧杯中物质的总质量比反应前减少了8.8g,则石灰石中碳酸钙的质量为多少克?所用盐酸的溶质质量分数为多少?老师用生锈的铜片、铁粉和稀硫酸进行实验,实验过程如下图所示(部分生成物已略去)。

努力****向丝
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















