



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
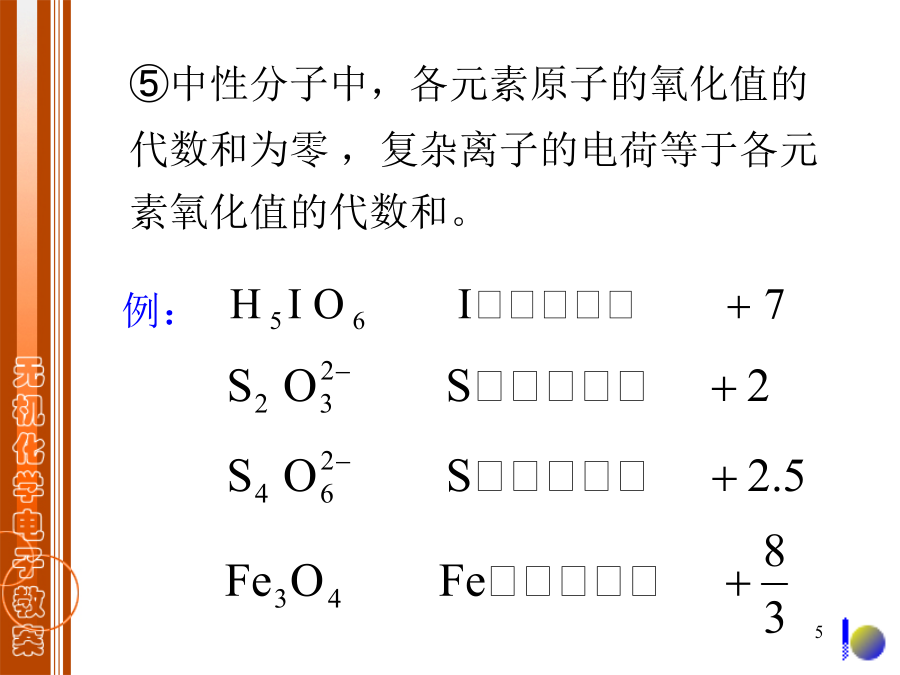
第七章氧化还原反应电化学基础§7.1氧化还原反应的基本概念7.1.1氧化值确定氧化值的规则:例:配平原则:①电荷守恒:氧化剂得电子数等于还原剂失电子数。②质量守恒:反应前后各元素原子总数相等。配平步骤:①用离子式写出主要反应物和产物(气体、纯液体、固体和弱电解质则写分子式)。②分别写出氧化剂被还原和还原剂被氧化的半反应。③分别配平两个半反应方程式,等号两边的各种元素的原子总数各自相等且电荷数相等。例1:配平反应方程式+例2:配平①×28+②×3得解:酸性介质:多n个O+2n个H+,另一边+n个H2O§7.2电化学电池7.2.1原电池的构造/Cu原电池符号(电池图示):例:将下列反应设计成原电池并以原电池符号表示。*7.2.2电解池与Faraday定律例如,铜电极,z=2,析出铜的质量7.2.3原电池电动势的测定7.2.4原电池的最大功与Gibbs函数§7.3电极电势7.3.1标准氢电极和甘汞电极2.甘汞电极(SCE))7.3.2标准电极电势2.电极电势的测定①采用还原电势;m17.3.3Nernst方程=))V,0.222VV解:0.55V小结:?解:0.0265V思考:KCNL0.36V§7.4电极电势的应用7.4.1判断氧化剂、还原剂的相对强弱7.4.2判断氧化还原反应进行的方向例:判断在酸性溶液中H2O2与Fe2+混合时,能否发生氧化还原反应?若能反应,写出反应方程式。进行?V07.4.3确定氧化还原反应进行的限度试求AgCl的溶度积常数。0.5769V7.4.4元素电势图1.判断歧化反应能否发生+)z(2)判断哪些物种可以发生歧化反应?解:(1)(2)V

你相****光吗
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















