


如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
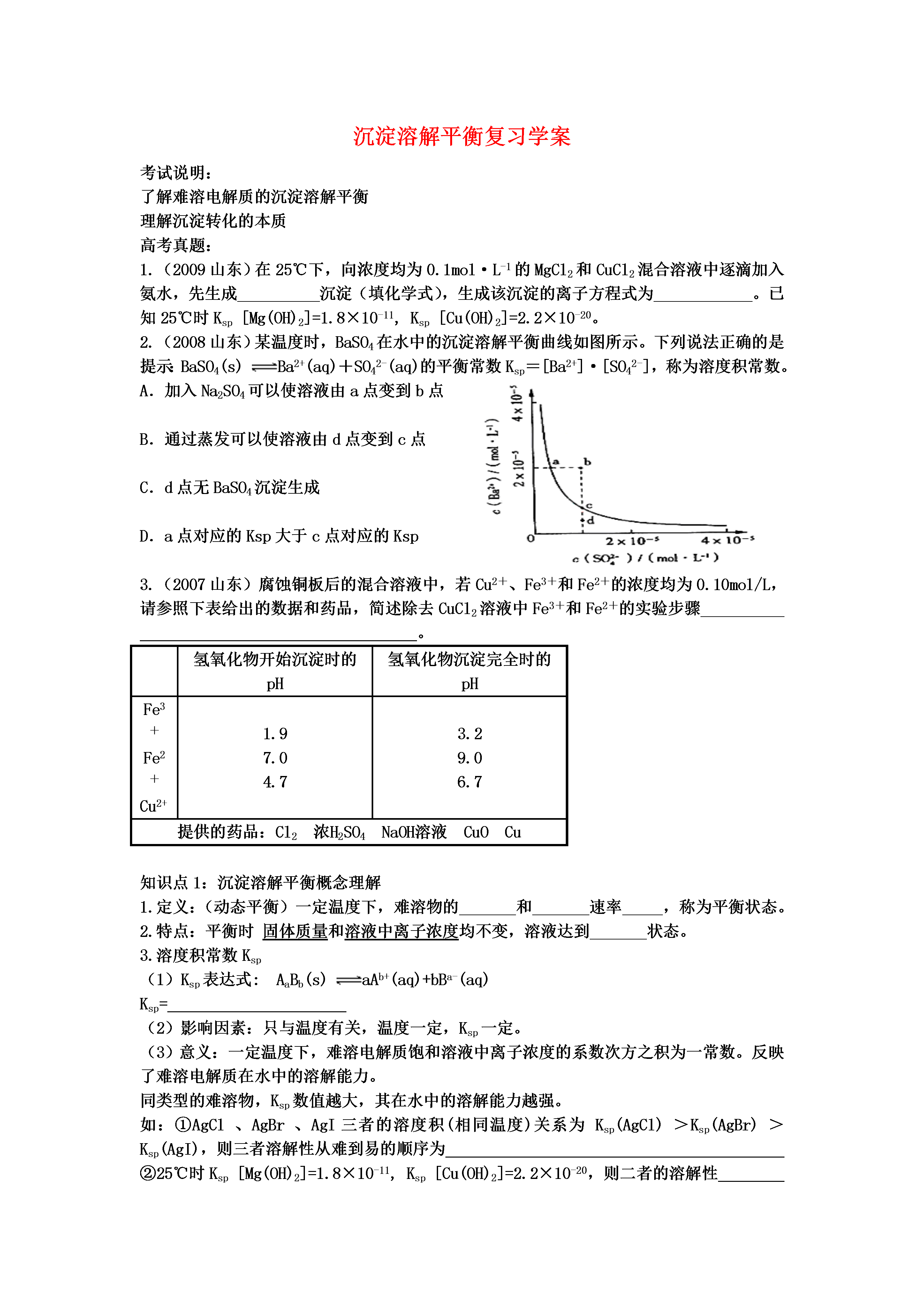
沉淀溶解平衡复习学案考试说明:了解难溶电解质的沉淀溶解平衡理解沉淀转化的本质高考真题:1.(2009山东)在25℃下,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。2.(2008山东)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是提示:BaSO4(s)Ba2+(aq)+SO42-(aq)的平衡常数Ksp=[Ba2+]·[SO42-],称为溶度积常数。A.加入Na2SO4可以使溶液由a点变到b点B.通过蒸发可以使溶液由d点变到c点C.d点无BaSO4沉淀生成D.a点对应的Ksp大于c点对应的Ksp3.(2007山东)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤。氢氧化物开始沉淀时的pH氢氧化物沉淀完全时的pHFe3+Fe2+Cu2+1.97.04.73.29.06.7提供的药品:Cl2浓H2SO4NaOH溶液CuOCu知识点1:沉淀溶解平衡概念理解1.定义:(动态平衡)一定温度下,难溶物的和速率,称为平衡状态。2.特点:平衡时固体质量和溶液中离子浓度均不变,溶液达到状态。3.溶度积常数Ksp(1)Ksp表达式:AaBb(s)aAb+(aq)+bBa-(aq)Ksp=(2)影响因素:只与温度有关,温度一定,Ksp一定。(3)意义:一定温度下,难溶电解质饱和溶液中离子浓度的系数次方之积为一常数。反映了难溶电解质在水中的溶解能力。同类型的难溶物,Ksp数值越大,其在水中的溶解能力越强。如:①AgCl、AgBr、AgI三者的溶度积(相同温度)关系为Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI),则三者溶解性从难到易的顺序为②25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20,则二者的溶解性知识点2:沉淀的溶解与转化沉淀的生成与溶解(1)沉淀的生成:①难溶电解质溶液中,若c(Ab+)a·c(Ba-)b>Ksp,则溶液为过饱和状态,出现沉淀。②难溶电解质饱和溶液中,若加入Ab+或者Ba-,则c(Ab+)a·c(Ba-)b>Ksp,也会析出沉淀。应用:除杂、分离如除去溶液中的杂质离子(Cu2+,Fe3+),可向溶液中引入OH-,从而生成极难溶沉淀物,达到除杂目的。思考:沉淀溶解平衡是可逆过程,试分析杂质离子能否通过沉淀法除尽;由Ksp的表达式分析,要使除去的离子在溶液中残留浓度尽量小,需引入的沉淀剂。(2)沉淀的溶解:①难溶电解质饱和溶液加水稀释,c(Ab+)a·c(Ba-)b<Ksp,溶液不再饱和,平衡正移,沉淀继续溶解。②离子间反应。向难溶电解质饱和溶液中引入某离子,其可与Ab+或者Ba-反应,导致c(Ab+)或者c(Ba-)减小,平衡正向移动,沉淀继续溶解。思考:试分析离子间反应的常见类型,并各举例说明之。沉淀的转化实质:沉淀溶解平衡的移动。(填“正向”或“逆向”)解释:向难溶电解质的饱和溶液体系中引入某离子,其可与Ab+或者Ba-反应,生成另一沉淀物。此时溶液中c(Ab+)或者c(Ba-)(填“增大”或“减小”)。通常表现为向转化。本质:沉淀转化的本质实际是原难溶物继续溶解的一种表现形式。练习:1.用离子方程式和沉淀溶解平衡的表达式分析向ZnS的平衡体系中加入CuSO4溶液后的沉淀转化。2.向5mLNaCl溶液中滴入一滴硝酸银溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变为黑色,根据上述变化,试分析三种难溶物的溶解度关系()A.AgCl﹦AgI﹦Ag2SB.AgCl﹤AgI﹤Ag2SC.AgCl﹥AgI﹥Ag2SD.AgI﹥AgCl﹥Ag2S在FeS饱和溶液中存在FeS(s)Fe2+(aq)+S2-(aq),常温下Ksp=8.1×10-17.又知FeS饱和溶液中[H+]与[S2-]之间存在以下定量关系,[H+]2·[S2-]=1.0×10-22,为了使溶液中[Fe2+]达到1mol/L,现将适量FeS投入其饱和溶液中,应调节溶液中[H+]为。书写具体计算过程:总结:溶液中离子反应的实质:.巩固练习题1.已知CaSO4的溶度积为2.5×10-5,如果用0.01mol·L-1的CaCl2溶液与等量的Na2SO4溶液混合

映雁****魔王
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















