


如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
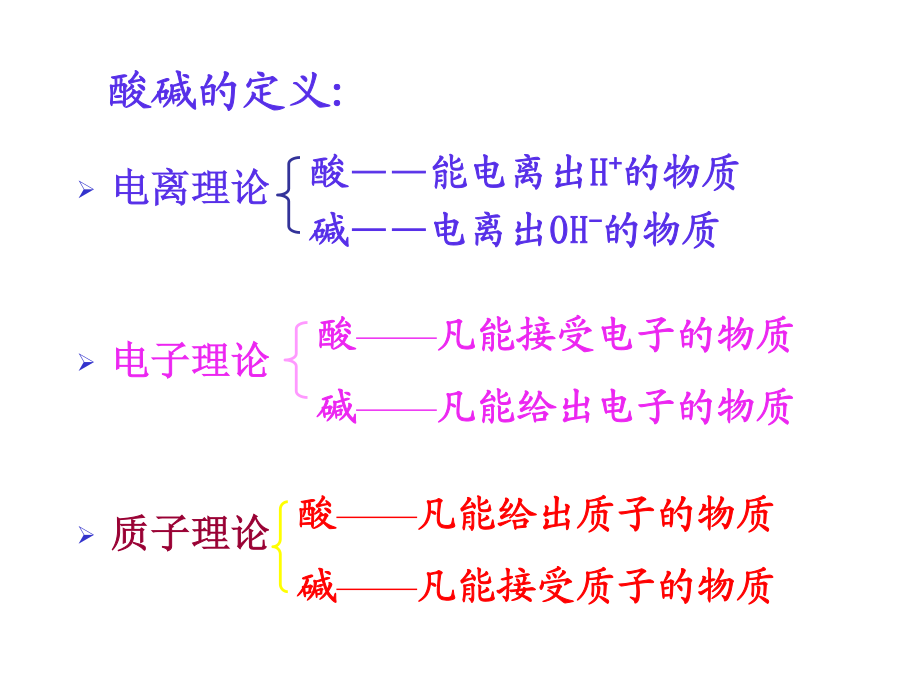
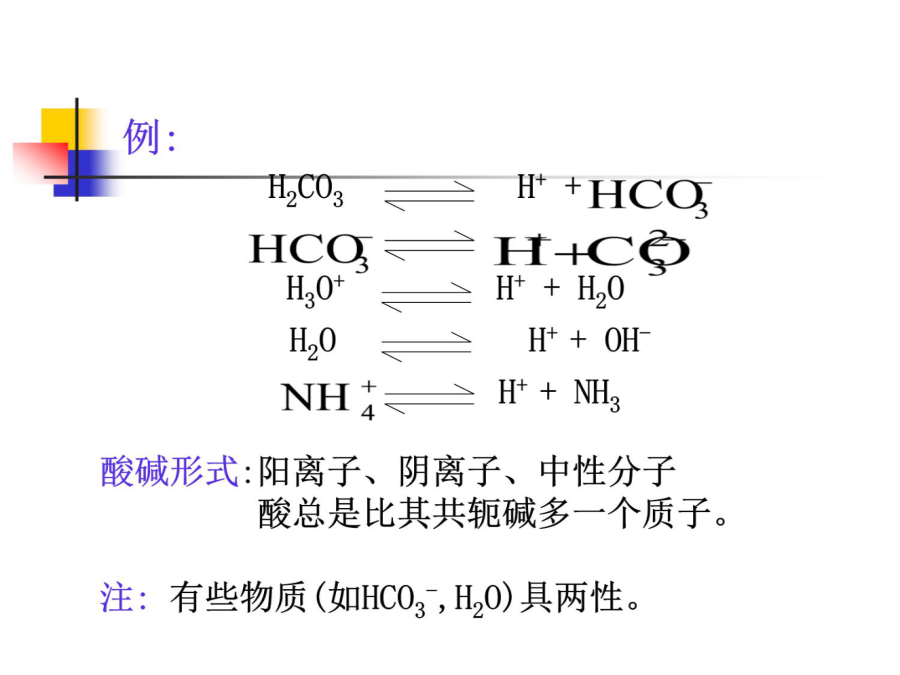
酸碱滴定法(中和滴定法): 以酸碱反应(水溶液中的质子转移反应)为基础的定量分析法。一、水溶液中的酸碱平衡酸碱的定义:H3O++A-3.酸碱反应的实质小结:4.酸碱的强度讨论:(2)多元酸碱的强度讨论:平衡浓度: 共轭酸碱对达平衡时,溶液中存在的各个酸碱型体的浓度。用[]表示。 分析浓度(总浓度): 溶液体系达平衡后,各种型体平衡浓度之和。 分布系数: 某型体的平衡浓度占总浓度的分数,为该型体的分布系数,以δ表示。 δ=[某型体平衡浓度]/总浓度 分布曲线: 分布系数δ与溶液pH值间的关系曲线(δ-pH)。讨论:设:HAc的分布系数为δ1;Ac-的分布系数为δ0;则:由上式,以δ对pH作图:讨论:2.二元酸:以草酸(H2C204)为例讨论:(H2C2O4pKa1=1.22;pKa2=4.19)四种型体:讨论:(H3PO4pKa1=2.12;pKa2=7.20;pKa3=12.36)结论:例:计算pH=5.0时,HAc溶液(0.1000mol/L) 中HAc和Ac-的分布系数及平衡浓度三、酸碱指示剂的变色原理及选择甲基橙:偶氮类,变色范围:4.4~3.1。 酸滴碱时用作指示剂。终点:黄色→橙色。酚酞:三苯甲烷类,变色范围:8.2~10.0。 碱滴酸时用作指示剂。终点:无色→红色。甲基橙: (1)有机弱碱 (2)双色指示剂 (3)变色范围在酸性区 (4)酸滴碱时用作指示剂2.酸碱指示剂的变色范围[In-]/[HIn]≤1/10,或pH≤pKHIn–1 [In-]/[HIn]≥10,或pH≥pKHIn+1 3.1/10≤[In-]/[HIn]≤10 或pKHIn–1≤pH≤pKHIn+1 酸碱指示剂理论变色范围:pH=pKHIn±1 酸碱指示剂理论变色点:pH=pKHIn,[In-]=[HIn] 注意:实际与理论的变色范围有差别,深色比浅色灵敏,指示剂的变色范围越窄,指示变色越敏锐。pKHIn讨论:3.滴定终点的确定方法2)电位滴定法:通过测定滴定过程中电位的变化,利用化学计量点附近电位的突跃,确定化学计量点。四、酸碱滴定法的基本原理NaOH(0.1000mol/L)→HCl(0.1000mol/L,20.00mL)(3)化学计量点,加入滴定剂体积为20.00mL 反应完全后溶液中[H+]=1.00×10-7mol·L-1 pH=7.00 (4)化学计量点后,加入滴定剂体积为20.02mL(过量约半滴): [OH-]=(0.1000×0.02)/(20.00+20.02) =5.00×10-5mol·L-1 pOH=4.30 pH=9.70强碱滴定强酸强碱滴定强酸强碱滴定强酸例:0.1000mol·L-1NaOH溶液滴定0.1000mol·L-1 HCl溶液。滴定突跃范围为:4.30-9.70。应选择何种指示剂? 甲基红:4.4-6.2酚酞:8.2-10.0 结论:均可作为该滴定反应的指示剂。滴定曲线的作用: (1)确定滴定突跃范围; (2)根据突跃范围选择 适宜指示剂; (3)确定滴定误差。2.强酸滴定强碱1)滴定过程中pH值的变化 2)滴定曲线的形状 3)影响滴定突跃的因素和指示剂的选择 4)弱酸被准确滴定的判别式3.强碱滴定弱酸(2)化学计量点前,加入滴定剂体积19.98mL 开始滴定后,溶液变为HAc(ca)-NaAc(cb)缓冲溶液: ca=0.020.1000/(20.00+19.98) =5.0010-5mol·L-1 cb=19.980.1000/(20.00+19.98) =5.0010-2mol·L-1 [H+]=Kaca/cb=10-4.74[(5.0010-5)/(5.0010-2)] =1.8210-8mol·L-1 pH=7.74 (3)化学计量点时: 生成HAc的共轭碱NaAc(弱碱),其浓度为: cb=20.000.1000/(20.00+20.00) =5.0010-2mol·L-1 pKb=14-pKa=14-4.74=9.26 [OH-]=cbKb =5.0010-210-9.26 =5.2410-6mol·L-1 pOH=5.28 pH=8.72(4)化学计量点后,加入滴定剂体积20.02mL [OH-]=(0.1000×0.02)/(20.00+20.02) =5.0×10-5mol·L-1 pOH=4.30 pH=9.70强碱滴定弱酸滴定曲线强碱滴定弱酸强碱滴定弱酸强碱滴定弱酸从滴定曲线上可以看出: ①强碱滴定弱酸的突跃范围要窄得多 ΔpH=9.70–7.74=1.96 ②在碱性区域,可选用酚酞作指示剂 甲基橙不能用于滴定弱酸的指示剂。 ③影响pH突跃范围的因素是: ⅰ酸碱的强度(即Ka或Kb的大小) Ka或Kb增大,则pH突跃

天马****23
 实名认证
实名认证
 内容提供者
内容提供者
最近下载
最新上传
高平市第一中学2023年高三综合题(三)物理试题.doc
鄂尔多斯市第一中学2022-2023学年高三3月份两校联考物理试题.doc
迪庆市重点中学2023届高考物理试题命题比赛模拟试卷(31).doc
赣州市红旗实验中学2023届高三下学期第一次模拟-物理试题试卷.doc
福建莆田秀屿下屿中学2023年高三高考考前指导卷(2)物理试题.doc
福建省龙海市第二中学2023年高三下学期第一次适应性考试物理试题.doc
福建省龙岩高中2023届高三第三次教学质量监测物理试题试卷.doc
福建省龙岩市龙岩第一中学2023届高三3月新起点考试物理试题.doc
福建省龙岩市龙岩一中2022-2023学年5月高三联考物理试题试卷.doc
福建省龙岩市长汀县新桥中学2023年下学期高三联考物理试题.doc


















