



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
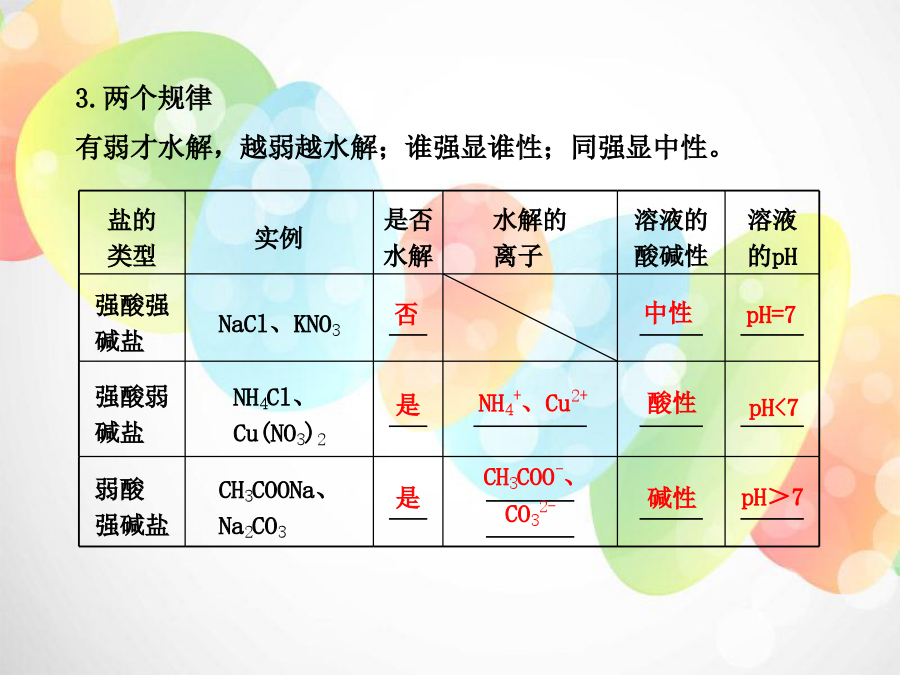
第三单元盐类的水解………三年16考高考指数:★★★★ 1.了解盐类水解的原理。 2.了解影响盐类水解程度的主要因素。 3.了解盐类水解的应用。一、盐类水解的原理 1.一个实质——“生成弱电解质” 生成弱电解质→破坏了_____________→水的电离程度______ →c(H+)≠c(OH-)→溶液呈碱性或酸性。 2.两个特点——“微弱”、“吸热” (1)程度微弱,属于可逆反应。 (2)吸热反应,是_________反应的逆反应。3.两个规律 有弱才水解,越弱越水解;谁强显谁性;同强显中性。4.水解方程式的书写 (1)一般盐类水解程度很小,水解产物很少,产物不标“↑” 或“↓”,如果产物易分解(如NH3·H2O、H2CO3)也不写成其分 解产物的形式, 如:NH4Cl的水解离子方程式:_______________________。 (2)多元弱酸盐的水解分步进行,以第一步为主,一般只写第 一步水解的离子方程式,如Na2CO3的水解离子方程式: _______________________________。(3)多元弱碱阳离子的水解方程式一步写完,如:FeCl3的水解 离子方程式:___________________________。 (4)若阴、阳离子水解相互促进,由于水解程度较大,书写时 要用“”、“↑”、“↓”等,如:NaHCO3与AlCl3混合溶液的 反应离子方程式:_____________________________。二、影响盐类水解的主要因素 可概括为:越弱越水解,越热越水解,越稀越水解。 1.内因 形成盐的酸或碱的强弱。对应的酸或碱_______就越易发生水 解。 如:酸性:CH3COOH>H2CO3相同浓度的Na2CO3、 CH3COONa溶液的pH大小关系为_________________________。2.外因 (1)温度、浓度。(2)外加物质。 外加物质对水解反应的影响取决于该物质的性质。 ①外加酸碱②加能水解的盐三、盐类水解的应用 1.用热的纯碱溶液洗油污 原因:___________________________________________;2.明矾净水 离子方程式: _______________________________________; 3.制备Fe(OH)3胶体 离子方程式: _______________________________________; 4.不能在溶液中制取Al2S3 表示原因的离子方程式: _______________________________________。1.pH相同的盐酸和氯化铵溶液中由水电离出的c(H+)相同。 () 【分析】不相同。盐酸溶液中水的电离被抑制,氯化铵溶液中水的电离被促进。 2.酸式盐溶液一定呈酸性。() 【分析】不一定。酸式盐溶液有的呈酸性,如NaHSO4溶液;有的酸式盐溶液呈碱性,如NaHCO3溶液。3.某盐的溶液呈酸性,该盐一定发生了水解反应。() 【分析】不一定。有些酸式盐溶液呈酸性,是因为电离产生了氢离子,并未发生水解,如NaHSO4溶液。 4.某盐溶液呈中性,该盐一定为强酸强碱盐。() 【分析】不一定。如弱酸弱碱盐CH3COONH4,因CH3COO-和NH4+的水解程度相同,溶液呈中性。 5.降低温度和加水稀释,都会使盐的水解平衡向逆反应方向移动。() 【分析】水解反应是吸热反应,降低温度可使水解平衡逆向移动,但加水稀释时,水解平衡正向移动,水解程度增大。溶液中粒子浓度大小的比较 1.两个平衡依据——“电离”、“水解” (1)电离平衡。 电离过程是微弱的,如H2CO3溶液中:c(H2CO3)>c(HCO3-)>c(CO32-)(多元弱酸分步电离逐级减弱) (2)水解平衡。 水解过程是微弱的。如Na2CO3溶液中: c(CO32-)>c(HCO3-)>c(H2CO3)(多元弱酸根离子分步水解逐级减弱)2.两个守恒关系——“电荷”、“物料” (1)电荷守恒。 溶液中所有阳离子所带的正电荷总数等于所有阴离子所带的负电荷总数。 如NaHCO3溶液中: c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) (2)物料守恒。 在电解质溶液中,某些微粒可能发生变化,但变化前后某种元素的原子个数守恒。 如0.1mol·L-1NaHCO3溶液中: c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol·L-13.一种思想——“追根寻源” 在比较离子浓度大小时,关键是分析溶液中的离子是来自于 哪里,是盐的水解剩余的还是水解生成的,再结合“两 弱”——弱电解质的电离、盐的水解都是微弱的,一般都不 超过10%,即可快速确定离子浓度大小。如在NaHCO3溶液中: NaHCO

13****88
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















