


如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
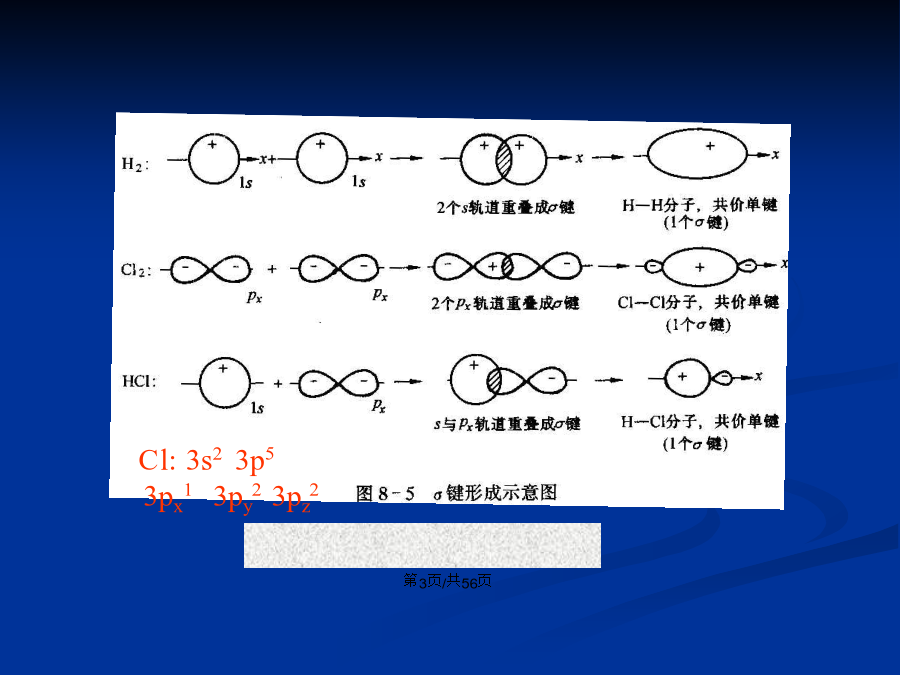
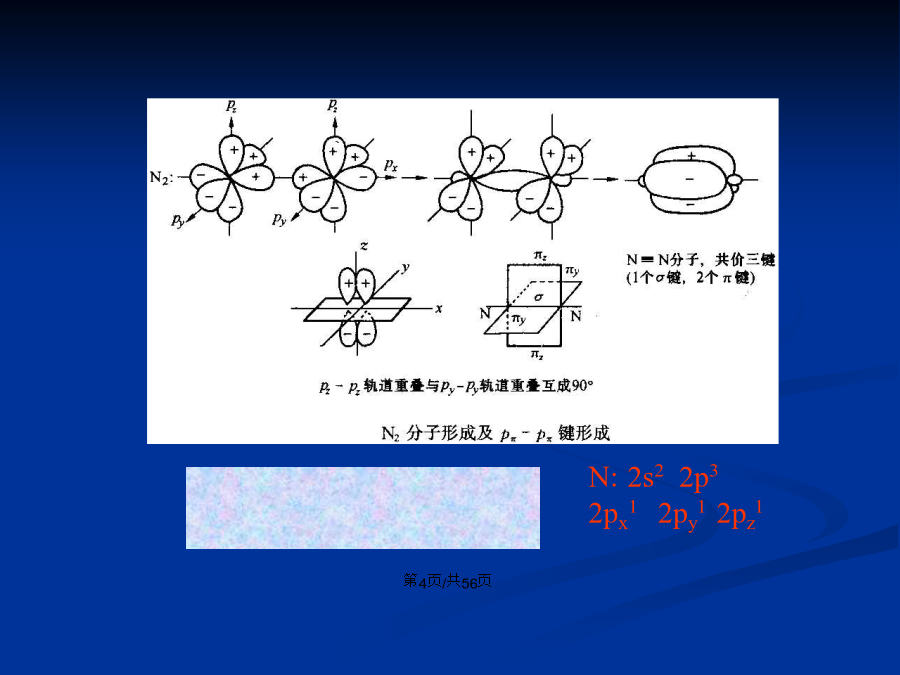
会计学1.理论要点: (1)两个原子相互接近时,自旋方向相反的单电子可以配对形成共价键。 (2)电子配对时放出能量越多,形成的化学键越稳定。 (3)原子轨道重叠部分越大,两核间电子概率越大,所形成共价键越牢固,分子也越稳定。 (4)能量相近的原子轨道可进行杂化后形成杂化轨道后成键。键:头碰头方式重叠键:肩并肩方式重叠 p-p键杂化轨道理论基本要点: ①成键时,原子中能量相近的原子轨道可以相互混合,重新组成新的原子轨道(杂化轨道) ②杂化轨道空间伸展方向会改变,轨道有更强的方向性和更强的成键能力。 ③形成的杂化轨道的数目等于参加杂化的原子轨道数目。 ④不同的杂化方式导致杂化轨道的空间分布不同,由此决定了分子的空间几何构型不同。杂化轨道的类型 sp3等性杂化: 一个s轨道和三个p轨道杂化,产生三个等同的sp3杂化轨道,sp3杂化轨道间夹角109º28’,呈四面体结构。如甲烷的形成。C:2s22p22s12p3四个sp3杂化轨道,形成四个σ键。sp2等性杂化: 一个s轨道和二个p轨道杂化,产生三个等同的sp2杂化轨道,sp2杂化轨道间夹角120º,呈平面三角形。如乙烯形成,C:2s12p3三个sp2杂化轨道(三个σ键)和一个p轨道(一个π键)。见书:p15,图2-6和2-7 sp等性杂化 sp杂化 一个s轨道和一个p轨道杂化形成二个等同的sp杂化轨道sp-sp轨道间夹角180°,呈直线型。如乙炔的C:2s12p3两个sp杂化轨道成两个σ键,两个p轨道成两个π键。 见书:p16,图2-9和2-10有机分子中O原子和N原子也常以杂化轨道而成键。如O,形成两个单键时,为不等性sp3杂化,形成双键时,以sp2轨道成键。 原子轨道组合成分子轨道必备条件:能量相近、电子云最大重叠、对称性相同。 如氢原子与氯原子结合时,氢原子的1s轨道与氯原子的3p轨道能量相近,而且只能与3px以波相相同时的组合才能形成最大重叠的组合,成为有效的共价键,与其他轨道的组合由于重叠程度过小无意义,与3px波相相反时的组合形成的是反键轨道,能量高,不利于分子的稳定。s-s组合px-px组合注意:这里不能对s、px、py、pz绝对化,如C的sp3杂化轨道与H的s轨道的组合相当于s-px组合。一、共价键的极性与极化性 (一)极性 不同原子间形成的共价键,由于原子电负性的不同,正负电荷重心不再重合,电负性大的一端显负电,电负性小的一端显正电。即在键的两端出现了正极和负极,这样的共价键具有极性,称极性共价键,简称极性键。 相同原子形成共价键电荷均匀分布,是非极性键。 键矩定义为:μ=q×d(D) 键的极性大小主要由成键原子间的电负性差值决定。 电负性差值越大,键的极性就越强。 分子的极性:可用偶极矩表示,等于各化学键键矩的向量和(二)极化性 是指在外电场作用下,共价键极性发生变化的能力。或者说极化性是指共价键对外电场的感受能力。 如三、键能 形成共价键过程中体系释放的能量或共价键断裂过程中体系吸收的能量。 多原子分子中,相同的化学键键能相等。 σ键的键能大于π键。 五、共价键的断裂方式和有机反应的类型2.异裂成键的一对电子完全为成键原子中的一个原子或基团所有,形成正、负离子。一、分子间作用力 1.范德瓦尔斯力:主要有偶极-偶极作用(取向力)和色散力。 结论:①分子量相同的分子,极性越大,相互间的作用力越强; ②极性相近的分子,分子量越大,分子间的作用力越强; ③当极性和分子量都相同时,分子间的距离越小,分子间的作用力越强。第三节分子间作用力及其影响常见的具有氢键的无机物有HF、H2O、NH3、无机含氧酸,常的具有氢键的有机物有:羧酸、醇、胺、蛋白质、糖等。因为这些分子中含有H-F、H-O、H-N键。要注意醛、酮分子间不含氢键,因为其中氢氧不直接相连。 氢键的强弱与X、Y的电负性以及原子半径的大小有关,X、Y的电负性越大,半径越小,形成的氢键越强。 (三)对某些物理性质的影响 1.对熔沸点的影响 分子量相近的化合物比较,能形成分子间氢键的物质,其熔、沸点要高于不能形成分子间氢键的物质。如醇、羧酸等比相应分子量的醛、酮、烃的熔、沸点高。 2.对溶解度的影响 在极性溶剂中,如果溶质分子和溶剂分子间能形成氢键,将有利于溶质分子的溶解。如苯酚比苯在水中的溶解度大。一、基本理论 某些分子、离子或自由基不能用某个单一的经典结构式来解释其某种性质时,我们同时用两个或多个经典结构式来共同表达其结构,这一过程称为共振。如在甲酸根离子中两个C-O键的键长均为126pm,介于单双键之间,可用下式表示。理论要点: 1.共振杂化体是单一物质,可用以表达分子的真实结构,但它既不是几个共振结构式

骑着****猪猪
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















