


如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
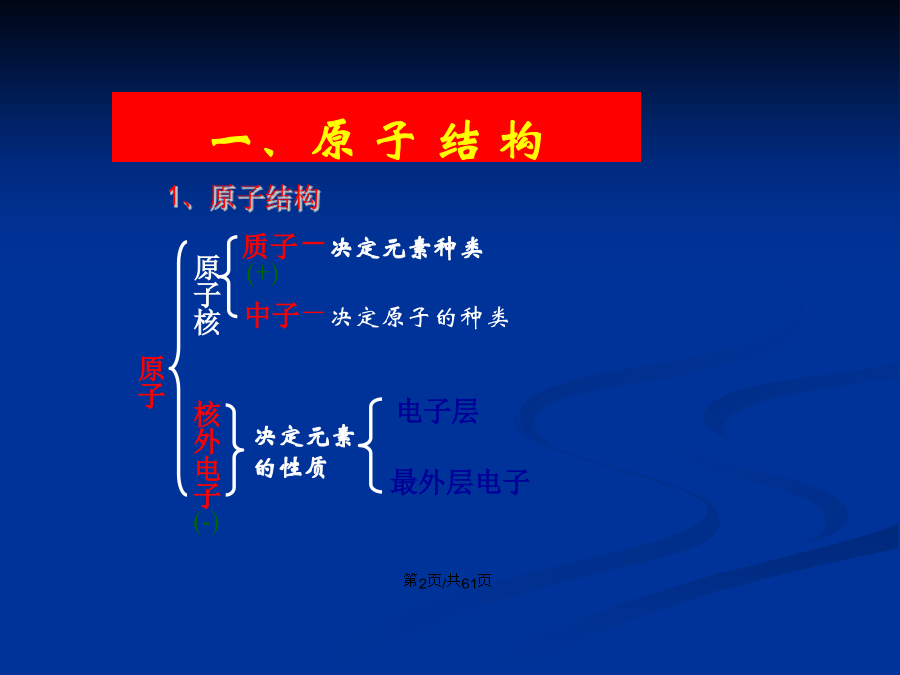
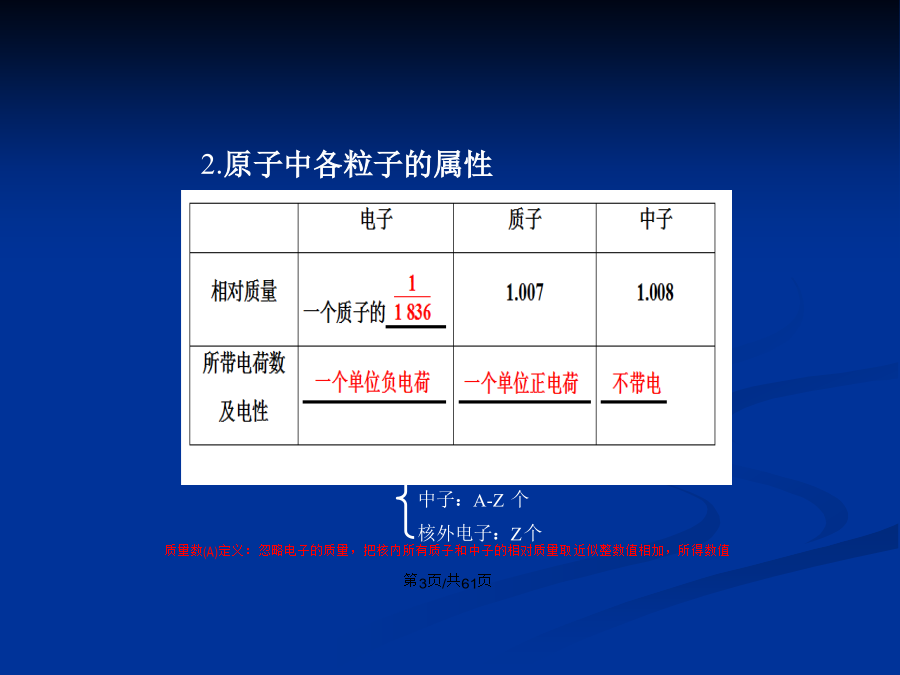
会计学(1)了解原子的组成及同位素的概念。掌握原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系。 (2)以第1、2、3周期的元素为例,了解原子核外电子排布规律。 (3)掌握元素周期律的实质,了解元素周期表(长式)的结构(周期、族)及应用。 (4)以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。 -决定元素种类2.原子中各粒子的属性质子数(Z)核电荷数原子序数核外电子数O4、核素同位素(1)同位素的化学性质几乎完全相同,物理性质略有差异; (2)天然存在的元素里,不论是游离态还是化合态,各同位素所占原子的百分比一般不变。二、核外电子的排布在多电子原子中,电子的能量不同,能量较低的电子在离核较近的区域运动,能量较高的电子在离核较远的区域运动,我们把不同的区域简化为不连续的壳层,也称作电子层,电子在原子核外分层运动,也称分层排布。电子层划分②各电子层容纳的电子数:Ne、HF、H2O、NH3、CH4(分子类) Na+、Mg2+、Al3+、NH4+、H3O+(阳离子类) N3-、O2-、F-、OH-、NH2-(阴离子类)三、元素周期律和元素周期表1869年门捷列夫在继承和分析了前人工作的基础上,对大量实验事实进行了订正、分析和概括,成功地对元素进行了科学分类。将化学性质相似的元素放在一个纵行制出了第一张元素周期表,揭示了化学元素的内在联系,使其构成一个完整的体系成为化学发展史上重要的里程碑之一。 他还预言了一些未知元素的性质都得到了证实。但是由于时代的局限,门捷列夫揭示的元素内在联系的规律还是初步的,他未能认识到形成元素性质周期性变化的根本原因。编制原则: (1)将电子层数相同的元素,按原子序数的递增顺序从左到右排成一横行—周期。 (2)把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排成纵行–18纵行。18周期1102、元素周期律A.周期性:(一)元素原子核外电子排布的周期性变化(二)元素原子半径的周期性变化主族元素原子半径的递变规律1、化合价递变规律金属性 (原子失电子能力)(专题)微粒半径大小比较规律:(变化的本质)金属性 (原子失电子能力)原子序数2.同主族元素金属性和非金属性的递变规律(一).碱金属元素ⅠA(除氢)(2)钾与H20的反应(二).卤族元素:卤素:易成盐元素ⅦA族元素卤素在自然界都以化合态形式存在,它们的单质可由人工制得。卤素在物理性质上的规律溴是深红棕色的液体,很容易挥发,应密闭保存。如果把溴存放在试剂瓶里,需要在瓶中加一些水,以减少挥发。卤素在化学性质上的规律(Cl2为代表金属,氢气,水,碱,还原性物质) (1)卤素单质与H2的反应(2)卤素间的置换反应【实验1-1】2F2+2H2O=4HF+O2④与金属:2Fe+3Br2=2FeBr3Fe+I2=FeI2 (2)递变性4、卤素化合物NaCl+AgNO3=AgCl↓+NaNO3 白色 NaBr+AgNO3=AgBr↓+NaNO3 浅黄色 KI+AgNO3=AgI↓+KNO3 黄色卤化银都有感光性,在光的照射下会发生分解反应2、Cl-、Br-、I-的检验不同情况下卤素的颜色卤族元素性质比较(1)氟及化合物 ①唯一无正价元素 ②与水反应方程式:2F2+2H2O=4HF+O2 ③与氢反应时阴暗处即爆炸 ④HF的沸点最高、HF酸为弱酸但能腐蚀玻璃 ⑤AgF易溶于水且无感光性 ⑥微量NaF对人体有益,可防龋齿 (2)其它卤素及化合物 ①Br2易挥发,液溴需加水保存(注意:保存卤素单质都不能用橡胶塞) ②I2加热易升华(喻:日照香炉生紫烟) ③淀粉遇I2显蓝色, ④I2与铁反应产物为:FeI2 ⑤HI受热易分解产生紫色气体 ⑥AgBr用于照相业;AgI用于人工降雨元素性质周期表的应用 A.推断元素位置、结构和性质/B、比较或推断一些性质C、寻找特定性质的物质/

骑着****猪猪
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















