学案-海南-2013_海南省海口市教育研究培训院九年级化学上册《原子的结构》学案(二)(无答案) 新人教版.rar
 立即下载
立即下载



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
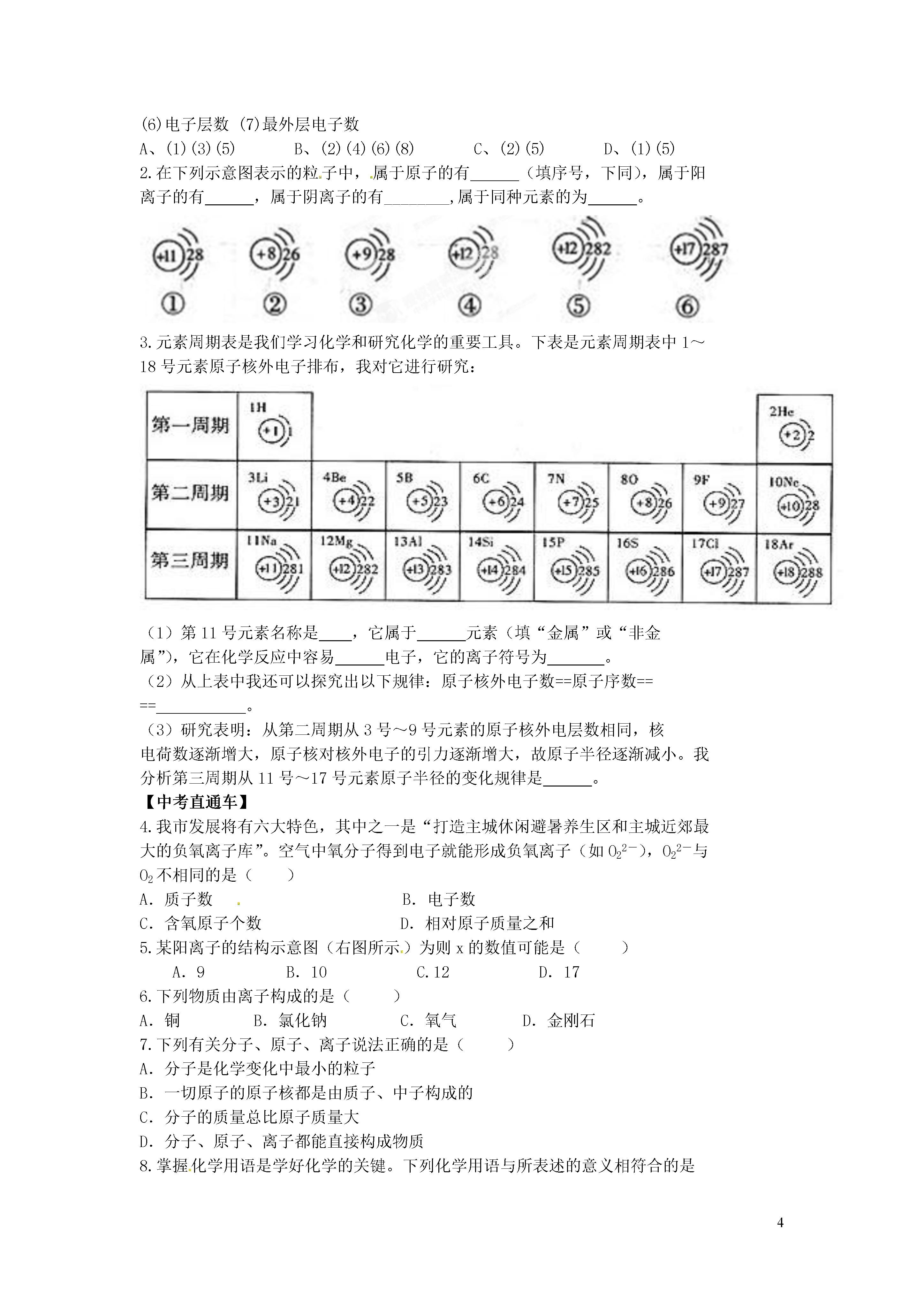
4《原子的结构》学案(二)【课前预习】1.构成物质的粒子有、、。如铁、水、食盐。2.原子的结构是怎样的?为什么整个原子不显电性。3.叙述原子和分子、原子和元素的联系与区别。【自主探究】知识点一:核外电子的排布【阅读】课本P54-55图文,思考下列问题:5.进一步的探究发现:元素的最外层电子数与元素的性质的关系★对照原子结构示意图,思考:O与S、F与Cl两组元素的化学性质如何?■元素的化学性质与原子的关系密切。而元素的种类是由原子的数决定的。【思考】由于金属元素、非金属元素的原子核外最外层没有达到稳定结构,在化学反应中容易失、得电子,从而达到稳定结构。那么,得失电子的结果怎样呢?知识点二:离子的形成【资料】①钠与氯气反应生成氯化钠。②钠和氯的原子结构示意图【讨论】要趋向稳定结构的钠原子和氯原子该如何变化来达到稳定呢?(达成共识后由两名同学上台表演氯化钠的形成过程。)【阅读】课本P55第三段图文。1.找出离子、阴离子、阳离子的概念,并举两例。2.说说书写离子符号应注意的事项。【小结】1.离子的形成:原子→阳离子→带正电原子→阴离子→带2.离子:带电的或叫离子。带正电的离子叫;带负电的离子叫。3.离子符号⑴表示方法:在元素符号(或原子团)右上角表明离子所带的电荷,数值在前,正、负号在后。离子带1个单位的正电荷或1个单位的负电荷时,“1”省略不写。如:阳离子:阴离子:⑵表示意义:表示离子(或一个离子),如:Mg2+——表示一个镁离子(一个镁离子带2个单位的正电荷)2Mg2+:表示两个镁离子(离子符号前面的化学系数表示离子的个数。)4.离子化合物:叫离子化合物【思考交流】1.原子与离子的比较;2.归纳原子、分子、离子、单质、化合物之间的关系。(书P79)【课堂小结】通过本节课的学习,你收获了什么?【我的收获】【小结】第三单元物质构成的奥秘课题二原子的结构(第二课时)课堂检测案【基础练习】课本P57-581~2题1.原子失去最外层电子或在最外层得到电子后,不发生变化的是()(1)元素种类(2)化学性质(3)相对原子质量(4)原子的电性(5)原子核(6)电子层数(7)最外层电子数A、(1)(3)(5)B、(2)(4)(6)(8)C、(2)(5)D、(1)(5)2.在下列示意图表示的粒子中,属于原子的有(填序号,下同),属于阳离子的有,属于阴离子的有 ________,属于同种元素的为。3.元素周期表是我们学习化学和研究化学的重要工具。下表是元素周期表中1~18号元素原子核外电子排布,我对它进行研究:(1)第11号元素名称是,它属于元素(填“金属”或“非金属”),它在化学反应中容易电子,它的离子符号为。(2)从上表中我还可以探究出以下规律:原子核外电子数==原子序数====。(3)研究表明:从第二周期从3号~9号元素的原子核外电层数相同,核电荷数逐渐增大,原子核对核外电子的引力逐渐增大,故原子半径逐渐减小。我分析第三周期从11号~17号元素原子半径的变化规律是。【中考直通车】4.我市发展将有六大特色,其中之一是“打造主城休闲避暑养生区和主城近郊最大的负氧离子库”。空气中氧分子得到电子就能形成负氧离子(如O22-),O22-与O2不相同的是()A.质子数B.电子数C.含氧原子个数D.相对原子质量之和5.某阳离子的结构示意图(右图所示)为则x的数值可能是()A.9B.10C.12D.176.下列物质由离子构成的是()A.铜B.氯化钠C.氧气D.金刚石7.下列有关分子、原子、离子说法正确的是()A.分子是化学变化中最小的粒子B.一切原子的原子核都是由质子、中子构成的C.分子的质量总比原子质量大D.分子、原子、离子都能直接构成物质8.掌握化学用语是学好化学的关键。下列化学用语与所表述的意义相符合的是()A、H2O——1个水分子B、.——1个钠离子C、3Fe3+——3个铁原子D、2H——2个氢元素9.下面是五种粒子的结构示意图:(1)图中粒子共能表示种元素。A所表示的元素位于元素周期表的第周期。(2)图中表示的阳离子是(用离子符号表示),表示的阴离子是(用离子符号表示),二者形成的化合物的化学式为。【拓展延伸】10、分析MgO的形成过程

是你****馨呀
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















