



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
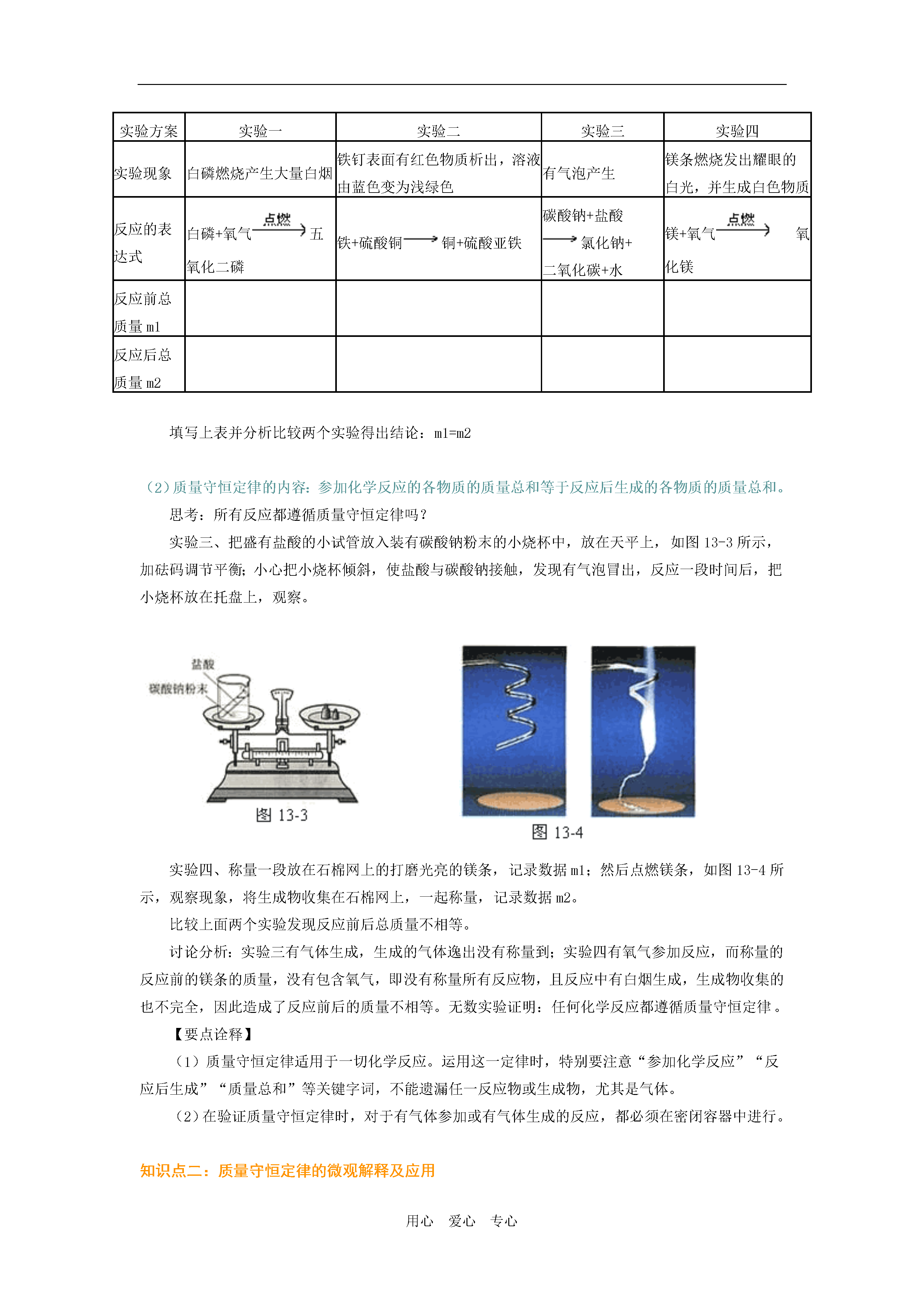
用心爱心专心周课题:质量守恒定律如何正确书写化学方程式[学习目标集成]1.认识质量守恒定律。2.从微观的角度认识在化学反应中原子的种类和数目不会发生改变。3.通过实验探究得出化学反应前后物质的总质量不变的结论。4.了解化学方程式的含义和读法,特别是各物质间的质量关系。5.能正确书写化学方程式,并能进行简单的质量关系的计算。重点:质量守恒定律的应用,化学方程式的书写。难点:对质量守恒定律的微观认识,化学方程式的配平。[知识要点梳理]知识点一:质量守恒定律(1)质量守恒定律的实验探究:实验一、白磷在氧气中燃烧利用如图13-1所示的装置进行实验:在底部铺细沙的锥形瓶中放入一粒火柴头大小的白磷,按图示装置好。先称量反应前容器及里面药品的质量,然后加热玻璃棒,点燃白磷,反应完全并冷却后再称量容器的总质量,记录并比较两个数据填写在下表中。该实验进行时要注意:整个反应过程中装置必须严密以及要等容器冷却到室温时再称量。实验二、铁和硫酸铜溶液反应如同13-2所示在烧杯中加入30mL硫酸铜溶液,将几根铁钉用砂纸打磨干净,一起放在天平上称量,记录数据。然后把铁钉放入烧杯中,过会会观察到铁钉表面有红色物质析出,且溶液变为浅绿色,这时候再称量烧杯及其中物质的质量,记录数据填写在下表中。实验方案实验一实验二实验三实验四实验现象白磷燃烧产生大量白烟铁钉表面有红色物质析出,溶液由蓝色变为浅绿色有气泡产生镁条燃烧发出耀眼的白光,并生成白色物质反应的表达式白磷+氧气五氧化二磷铁+硫酸铜铜+硫酸亚铁碳酸钠+盐酸氯化钠+二氧化碳+水镁+氧气氧化镁反应前总质量m1反应后总质量m2填写上表并分析比较两个实验得出结论:m1=m2(2)质量守恒定律的内容:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。思考:所有反应都遵循质量守恒定律吗?实验三、把盛有盐酸的小试管放入装有碳酸钠粉末的小烧杯中,放在天平上,如图13-3所示,加砝码调节平衡;小心把小烧杯倾斜,使盐酸与碳酸钠接触,发现有气泡冒出,反应一段时间后,把小烧杯放在托盘上,观察。实验四、称量一段放在石棉网上的打磨光亮的镁条,记录数据m1;然后点燃镁条,如图13-4所示,观察现象,将生成物收集在石棉网上,一起称量,记录数据m2。比较上面两个实验发现反应前后总质量不相等。讨论分析:实验三有气体生成,生成的气体逸出没有称量到;实验四有氧气参加反应,而称量的反应前的镁条的质量,没有包含氧气,即没有称量所有反应物,且反应中有白烟生成,生成物收集的也不完全,因此造成了反应前后的质量不相等。无数实验证明:任何化学反应都遵循质量守恒定律。【要点诠释】(1)质量守恒定律适用于一切化学反应。运用这一定律时,特别要注意“参加化学反应”“反应后生成”“质量总和”等关键字词,不能遗漏任一反应物或生成物,尤其是气体。(2)在验证质量守恒定律时,对于有气体参加或有气体生成的反应,都必须在密闭容器中进行。知识点二:质量守恒定律的微观解释及应用(1)质量守恒定律的实质:化学反应的实质是参加反应的各物质中的原子重新组合生成新物质分子的过程,在化学反应前后,原子的种类没有改变、数目没有增减、原子的质量也没有改变,如图13-5所示水分子的分解示意图。因此参加化学反应的各物质的质量总和与反应后生成的各物质的质量总和必然相等。以上可总结为“五个不变,两个改变,一个可能变。”(2)质量守恒定律的应用①解释常见化学现象中的质量关系,如:铁生锈质量增加,木炭燃烧成灰质量减少等。②利用质量守恒定律,根据化学方程式确定物质的化学式;③利用质量守恒定律,根据化学方程式确定物质的相对分子质量;④熟练进行化学方程式的配平;根据题中所给的信息,利用质量守恒定律写出未学过的化学反应方程式;根据化学方程式求某元素质量;⑤利用质量守恒定律,根据化学方程式求反应中某物质的质量;⑥结合化学方程式中各物质的质量比,判断某反应物是否全部参加了反应……【要点诠释】理解质量守恒定律时一定要注意:(1)反应前后,元素种类不变,同种元素质量相等,但元素组成的物质的种类发生改变。(2)反应前后,原子种类不变,原子数目也不变,但分子的种类一定改变,分子的数目不一定改变。知识点三:化学方程式(1)化学方程式:用化学式来表示化学反应的式子。(2)化学方程式提供的信息意义实例(S+O2SO2)①表示反应物、生成物以及反应条件反应物是硫、氧气,生成物是二氧化硫,反应条件是点燃②表示反应物、生成物之间的质量关系(即质量比)S+O2SO232:16×2:32+16×232:32:64即1:1:2③表示反应物、生成物之间的粒子数关系(粒子个数比)S+O2SO21:1:1(3)化学方程式的读法①质的方面:硫和氧气在点燃条件下反应生成二氧化硫。②量的方面:每32份质量的硫和32份质量的氧气

小沛****文章
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















