



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
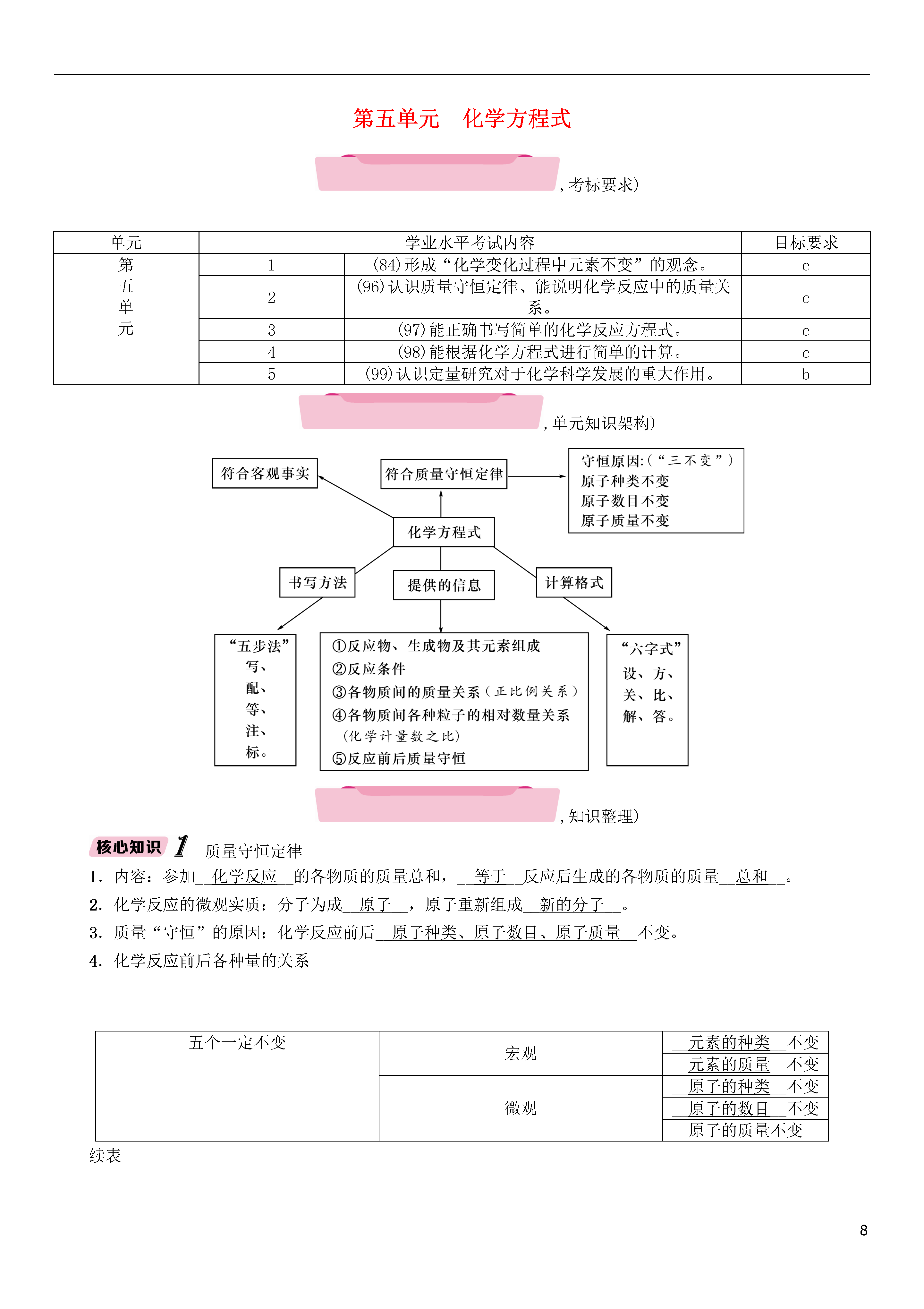
8第五单元化学方程式,考标要求)单元学业水平考试内容目标要求第五单元1(84)形成“化学变化过程中元素不变”的观念。c2(96)认识质量守恒定律、能说明化学反应中的质量关系。c3(97)能正确书写简单的化学反应方程式。c4(98)能根据化学方程式进行简单的计算。c5(99)认识定量研究对于化学科学发展的重大作用。b,单元知识架构),知识整理)质量守恒定律1.内容:参加__化学反应__的各物质的质量总和,__等于__反应后生成的各物质的质量__总和__。2.化学反应的微观实质:分子为成__原子__,原子重新组成__新的分子__。3.质量“守恒”的原因:化学反应前后__原子种类、原子数目、原子质量__不变。4.化学反应前后各种量的关系五个一定不变宏观__元素的种类__不变__元素的质量__不变微观__原子的种类__不变__原子的数目__不变原子的质量不变续表两个一定变宏观__物质__种类一定变微观__分子__种类一定变两个可能变宏观__元素化合价__可能变微观__分子数目__可能变5.质量守恒定律的应用(1)解释一些实验事实:如铜粉在空气中加热后,生成物的质量与铜的质量相比增加了;铁与硫酸铜溶液反应后,溶液质量减小了等。(2)推测物质的元素组成:如某物质在氧气中充分燃烧后,有水和二氧化碳生成,则该物质一定含有__碳、氢__元素,__可能__含有氧元素。(3)推断物质的化学式:根据化学反应前后元素的原子种类和原子数目均没有改变,推求出某一反应物(或生成物)的原子构成即__化学式__。(4)计算有关反应物质的质量:根据反应前后物质的__质量总和__相等,求其中某一物质的质量。【注意事项】①质量守恒定律只适用于化学反应。②“参加反应的各物质质量”是指实际参与反应了的物质的质量,是按化学方程式中反应物之间的质量比来确定的,未反应和超出质量比的部分不能计算在内。③质量守恒定律是指质量守恒,而非体积守恒等。④在计算质量总和时,特别注意不能忽略反应物和生成物中气体的质量、沉淀的质量。⑤“守恒”除“质量守恒”外,还指“元素种类、原子种类、原子数目守恒”。化学方程式1.定义:用__化学式__来表示化学反应的式子叫化学方程式。2.意义:(1)质的方面:能表示出__反应物__、__生成物__及其元素组成;表示__反应条件__。(2)量的方面:(宏观)能表示反应物、生成物的__质量比__;(微观)能表示反应物、生成物的各物质的__粒子(分子或原子)之间的个数比__;反应前后各物质__质量总和__相等。3.读法:什么物质与(“+”读作“__跟、和、与__、在……之中”等)什么物质在什么条件下反应,生成(“===”读作“__生成__”)什么物质和什么物质。4.书写的原则:(1)以__客观事实__为依据。(2)遵循__质量守恒定律__。5.书写步骤:“写、配、等、标、注”。(1)写:写反应物和生成物的化学式,注意用“__化合价代数和为零__”的原则判断正误。(2)配:在化学式__前面__配上系数,使前后__原子种类和数目__相等。注意不能改变化学式中元素符号右下角的数字!(3)等:将短线“-”改为等号“===”。(4)注:注明反应发生的条件,如点燃、“△”、高温、催化剂、光照、加压等。(5)标:反应前,反应物无固体、无气体,反应后有__沉淀和气体__生成时,分别在相应生成物化学式右边用“↓”和“↑”标注。6.配平方法:(1)__最小公倍数法__。(2)__奇数配偶法__。(3)__观察法__。【注意事项】①化学式书写正确与否,一定要用“化合物中元素化合价代数和为零”的原则来检验。②化学方程式一定要配平,配平后化学式前面的系数称为化学计量数。③一定要加注反应的条件、产物的状态。如果反应物中有气体,则气体生成物就不注“↑”,同样,溶液中的反应,如果反应物中有不溶性固体,固体生成物也不注“↓”。化学方程式的简单计算1.计算依据:质量守恒定律即化学方程式中各物质的质量__成正比例关系__,且固定不变。2.根据化学方程式计算的步骤:(1)设:设未知数(__不能带单位__)。(2)方:写化学方程式(__一定要配平__)。(3)关:标出关系量即已知物、未知物的__相对分子质量总和__及其实际质量(__带单位__)。(4)比:列比例式(__带单位__)。(5)解:求解(__带单位__)。(6)答:简要写出答案(带单位)。3.基本题型:(1)已知一种物质(反应物或生成物)的质量,求另一种物质(生成物或反应物)的质量。(2)已知反应前、后物质的质量(间接告知某反应物或生成物的质量),求另一生成物(或反应物)的质量。【注意事项】①化

猫巷****奕声
 实名认证
实名认证
 内容提供者
内容提供者
最近下载