



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
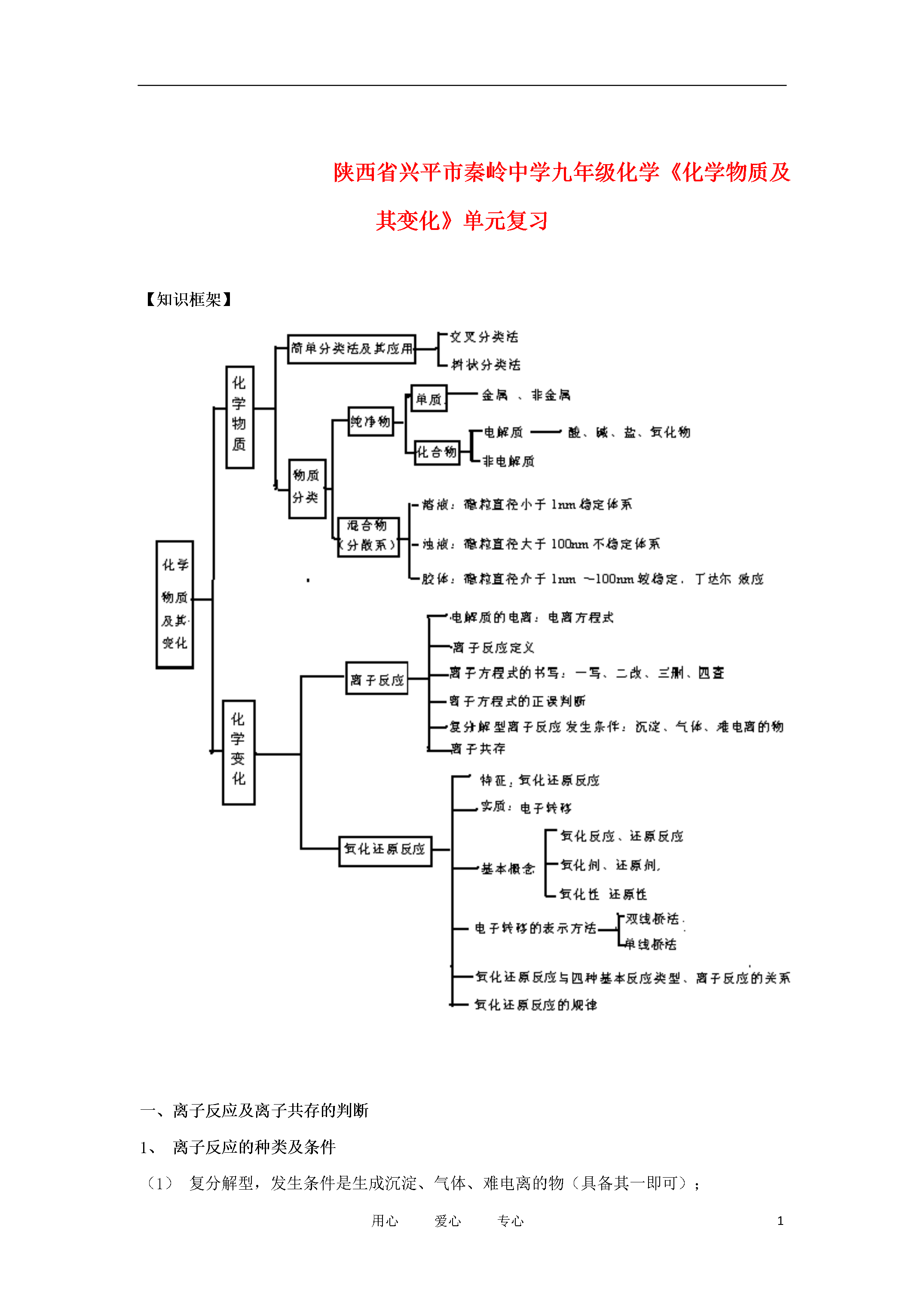
8用心爱心专心陕西省兴平市秦岭中学九年级化学《化学物质及其变化》单元复习【知识框架】一、离子反应及离子共存的判断1、离子反应的种类及条件(1)复分解型,发生条件是生成沉淀、气体、难电离的物(具备其一即可);(2)氧化还原型:发生条件是有电子转移(即符合强生弱)。无论哪类离子反应,其在实质都是使溶液中某种或多种离子的浓度发生变化(增多或减少)。2、离子共存的判断离子之间能否大量共存,实际是判断离子之间能否发生化学反应,若不发生反应即可共存,若反应则不能共存。(1)看清要求。是“能大量共存”还是“不能大量共存”,是“一定能大量共存”还是“可能能大量共存”。(2)看清题目是否有前提条件。若“在强酸性溶液中”,则每组离子中再增加H+;若“在强碱性溶液中”,则每组离子中再增加OH-;是否限定无色溶液;是否限制“因------反应不能大量共存”;是否限定溶液中已存在某些离子等。(3)看是否生成难电离物质。常见的难电离物质有H2O、NH3·H2O(NH4+与OH-生成)、CH3COOH(CH3COO-与H+生成)等。(4)看离子间能否发生氧化还原反应。如Fe3+与I-、S2-等不能大量共存。(5)注意HCO3-在强酸性和强碱性溶液中都不能大量共存,HCO3-+H+=CO2↑+H2O,HCO3-+OH-=CO32-+H2O。【例题1】在强酸性或强碱性溶液中都能大量共存的一组离子是()A.Ba2+,Cu2+,Br-,NO3-B.Na+,Ca2+,HCO3-,NO3-C.K+、Cu2+,SO42-,Na+D.Na+,K+,NO3-,SO42-(1)在强酸性条件下(即有大量H+),不能共存的离子有:OH-(大量)、CO32-、HCO3-、等,即:OH-和弱酸的酸根、弱酸的根式根离子不能与H+共存。(2)在强碱性条件下(即有大量OH-);不能共存的离子有:H+(大量)、HCO3-、Cu2+等,即:H+及弱酸的酸式根离子、弱碱的阳离子不能与OH-共存。(3)相互反应生成沉淀的离子间不能共存,如Ag+跟Cl-,Ba2+跟CO32-、SO42-等。(4)相互反应生成气体的离子间不能共存,如H+跟HCO3-等。(5)相互反应生成难电离物质的离子间不能共存,如H+跟OH-等【例题2】在强酸性或强碱性溶液中都能大量共存的一组离子是()A.Ba2+,Cu2+,Br-,NO3-B.Na+,Ca2+,HCO3-,NO3-C.K+、Cu2+,SO42-,Na+D.Na+,K+,NO3-,SO42-【方法规律】在解决此类题目时,结合具体问题,还要把握以下几点:(1)首先要注意审题,除考虑离子间能否发生反应外,还必须考虑限制条件,像①溶液的酸碱性环境怎样,②溶液的颜色情况,③溶液是否透明,④能发生氧化还原反应等。对隐含条件型问题,必须先将隐含条件揭示出来,判断清楚溶液的酸碱性,然后考虑离子间的反应情况。又如题目是要求选正确的还是选不正确的,要看清楚。(2)注意前后(题干条件、要求与选项)联系,不要丢三落四,思维要严谨。3、氧化还原反应二、氧化还原反应的基本规律及计算1、氧化还原反应的基本规律(1)守恒规律①对于一个完整的氧化还原反应,要遵循电子守恒,即失电子总数与得电子总数相等,表现为化合价升高总数与降低总数相等。②氧化还原型的离子反应,要遵循电子守恒及电荷守恒。应用:常用于有关氧化还原反应的计算及配平氧化还原反应方程式。(2)强弱规律应用:①在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质;用还原性较强的物质制备还原性较弱的物质;②判断氧化还原反应能否发生;③可用于比较物质间氧化性或还原性的强弱。(3)转化规律氧化还原反应中,以元素相邻价态之间的转化最容易;同种元素不同价态之间发生反应,元素的化合价只靠近而不交叉;同种元素相邻价态之间不发生氧化还原反应。例如:应用:判断氧化还原反应能否发生及表明电子转移情况。(4)先后规律一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,氧化性最强的优先发生反应。应用:判别物质的稳定性及反应先后顺序。2、氧化还原反应的计算(1)、计算依据得失电子守恒,即氧化剂得电子总数与还原剂失电子总数相等或化合价升高总数与化合价降低总数相等。(化学解题中经常用到守恒思想,主要包括以下几种情况:①正负化合价代数和为零的守恒思想。②阴阳离子正负电荷总数相等的守恒思想。③质量(或物质的量)相等的守恒思想。④得失电子总数相等的守恒思想。)(2)计算方法——得失电子守恒法对于氧化还原反应的计算,可以根据氧化还原反应的实质——反应中氧化剂得电子总数与还原剂失电子总数相等,即得失电子守恒求解。(对于多步连续进行的氧化还原反应,只要中间各步反应过程电子没有损耗,可直接找出起始物和最终产物,删去中间产物,建立二者之间

一吃****仕龙
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















