

如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
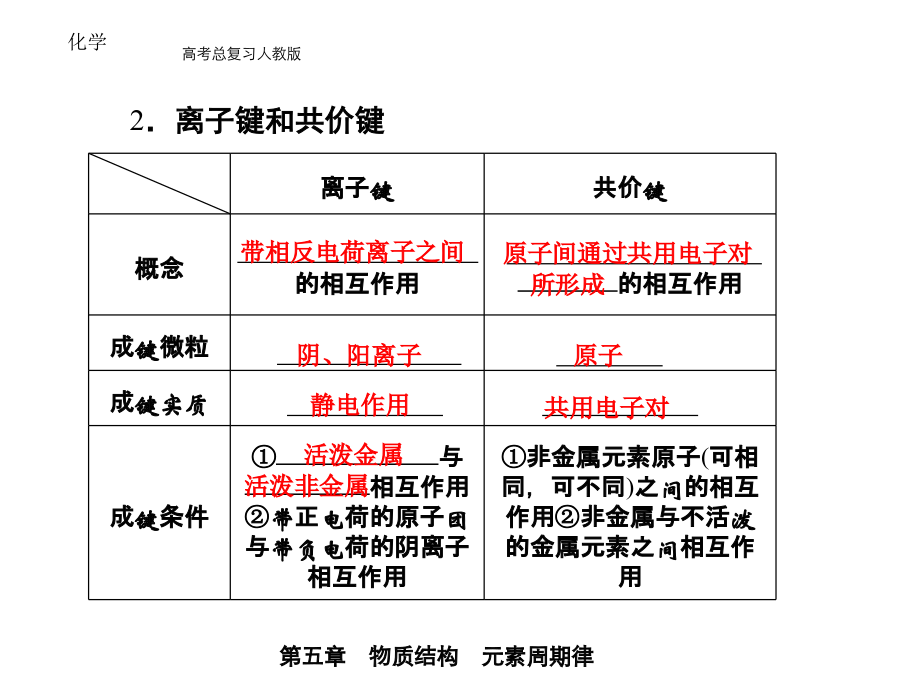
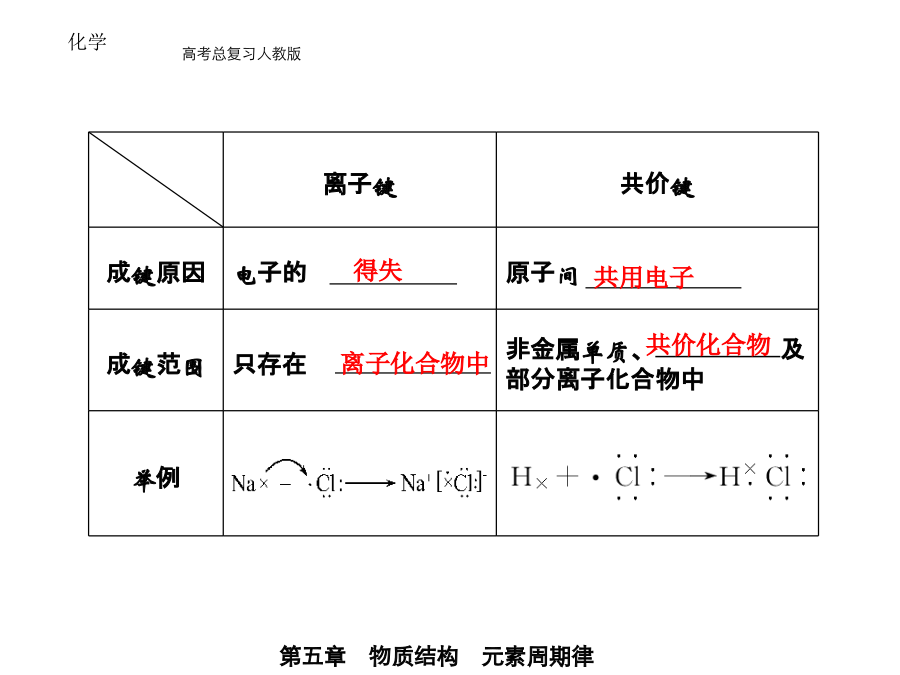
1.化学键 (1)定义: 的作用力. (2)分类(3)化学反应的实质 ①化学键的形成 化学键的形成与 有关. ②化学反应的本质 反应物分子中 和生成物分子中 .2.离子键和共价键3.分子间作用力和氢键 (1)分子间作用力 ①定义:把 的作用力,又叫. ②特点 A.分子间作用力比化学键 ; B.影响物质的物理性质,如 ,而化学键影响物质的化学性质和物理性质. C.只存在于由共价键形成的多数 和绝大多数 及稀有气体之间,如CH4、O2、Ne等.③规律 一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力 ,物质的熔沸点 . 例如:熔沸点:HClHBrHI.(2)氢键 ①定义: 的相互作用. ②特点 A.作用力的大小: >氢键> B.影响物质的物理性质,使物质的熔、沸点升高等. ③形成条件:分子中含有得电子能力 的元素,如 .④作用 A.自然现象; B.生命现象. 1.关于离子键、共价键的各种叙述,下列说法中正确的是 () A.在离子化合物里,只存在离子键,没有共价键 B.非极性键只存在于双原子的单质分子(如Cl2)中 C.在共价化合物分子内,一定不存在离子键 D.由多种元素组成的多原子分子里,一定只存在极性键解析:A项,如NH4Cl有共价键;B项,如H2O2中氧的原子间为非极性键;C项,若有离子键,则属于离子化合物;D项,如H2O2、C2H2中,都存在非极性键. 答案:C 2.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是 () A.NH4ClNH3↑+HCl↑ B.NH3+CO2+H2O===NH4HCO3 C.2NaOH+Cl2===NaCl+NaClO+H2O D.2Na2O2+2CO2===2Na2CO3+O2解析:本题以四个化学反应为载体综合考查了学生对离子键、极性共价键和非极性共价键的认识程度.A、B中无非极性键的断裂和形成,C中有非极性键(Cl-Cl)的断裂但无非极性键的形成.D中Na2O2既有离子键又有非极性共价键,CO2中有极性共价键,O2中有非极性共价键,故选D. 答案:D3.下列过程中,共价键被破坏的是 () A.碘升华B.溴蒸气被木炭吸附 C.酒精溶于水 D.HCl气体溶于水 解析:A、B、C只破坏了分子间作用力,没破坏化学键,HCl溶于水后,完全电离为H+和Cl-,H-Cl键被破坏. 答案:D4.下列关于氢键的说法不正确的是 () A.HF的沸点比HCl的沸点高是由于HF分子间存在氢键 B.水在结冰时体积膨胀,是由于水分子之间存在氢键 C.NH3的稳定性很强,是因为其分子间能形成氢键 D.在氨水中水分子和氨分子之间也存在着氢键 解析:氢键是一种较强的分子间作用力,它主要影响物质的物理性质,而物质的稳定性属于化学性质.氢键是某些氢化物(NH3、H2O、HF)分子间存在的比分子间作用力稍强的作用力,它的存在使氢化物的熔、沸点相对较高,因此HF的沸点高是由氢键所致,A项正确;水在结冰时体积膨胀是由于水分子大范围的以氢键互相联结,形成相对疏松的晶体,从而在结构上有许多空隙,造成体积膨胀,B项正确;NH3的稳定性取决于N-H键,而不是氢键,C项不正确;氨分子和水分子之间主要是以氢键结合的,故D项正确. 答案:C 1.概念辨析 (1)离子化合物:含有离子键的化合物.常见离子化合物包括:①大多数盐(如NaCl、Na2SO4、KNO3等);②强碱[如NaOH、KOH、Ba(OH)2等];③大多数碱性氧化物(如Na2O、CaO、MgO等).(2)共价化合物:只含有共价键的化合物.常见共价化合物包括:①非金属氢化物(如HCl、H2S、H2O等);②含氧酸(如H2SO4、HNO3、H3PO4等);③非金属氧化物(如CO、CO2、SO2等). 2.判断方法 (1)根据构成化合物的元素种类来判断.一般地,活泼金属(第ⅠA、ⅡA族)和活泼非金属(第ⅥA、ⅦA族)的元素,原子间形成的是离子键,对应的物质是离子化合物;同种或不同种非金属原子之间形成的是共价键,对应的物质是共价化合物. (2)根据化合物的类型来判断.大多数碱性氧化物、强碱和盐属于离子化合物;非金属氢化物、非金属氧化物、含氧酸属于共价化合物.(3)根据化合物的性质来判断.熔点、沸点较低的化合物是共价化合物.溶于水后不能发生电离的化合物是共价化合物,熔融状态下能导电的化合物是离子化合物. 3.与化学键的关系 离子化合物一定含有离子键,也可含有共价键;共价化合物一定不含离子键,只含共价键. (1)只含离子键的离子化合物,如NaCl、K2O等. (2)只有非金属元素构成的离子化合物,如NH4Cl、NH4NO3等. (3)含有极性键的离子化合物,如NaOH、Ba(OH)2

悠柔****找我
 实名认证
实名认证
 内容提供者
内容提供者
最近下载
最新上传
浙江省宁波市2024-2025学年高三下学期4月高考模拟考试语文试题及参考答案.docx
汤成难《漂浮于万有引力中的房屋》阅读答案.docx
四川省达州市普通高中2025届第二次诊断性检测语文试卷及参考答案.docx
山西省吕梁市2025年高三下学期第二次模拟考试语文试题及参考答案.docx
山西省部分学校2024-2025学年高二下学期3月月考语文试题及参考答案.docx
山西省2025年届高考考前适应性测试(冲刺卷)语文试卷及参考答案.docx
全国各地市语文中考真题名著阅读分类汇编.docx
七年级历史下册易混易错84条.docx
湖北省2024-2025学年高一下学期4月期中联考语文试题及参考答案.docx
黑龙江省大庆市2025届高三第三次教学质量检测语文试卷及参考答案.docx


















