


如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
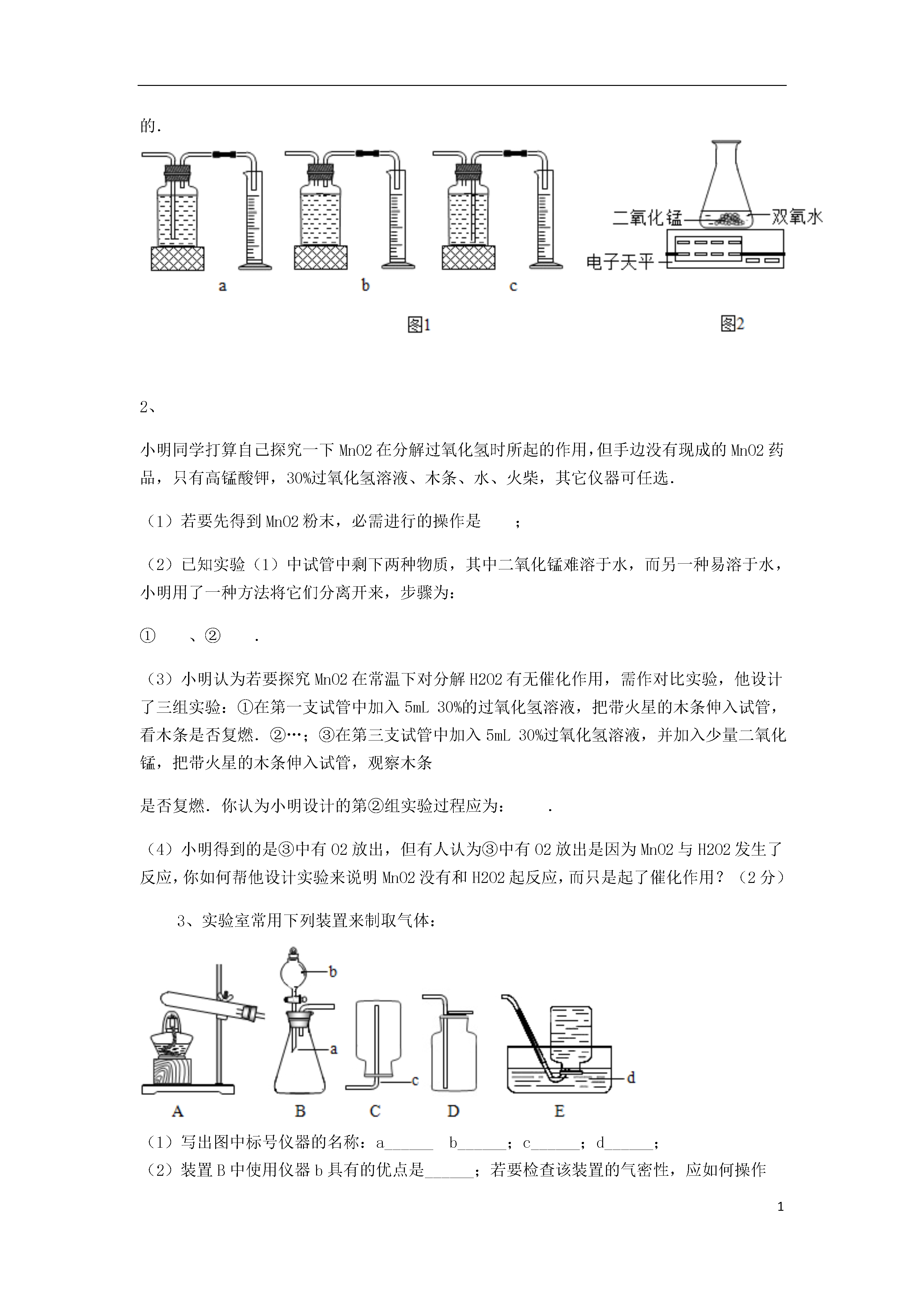
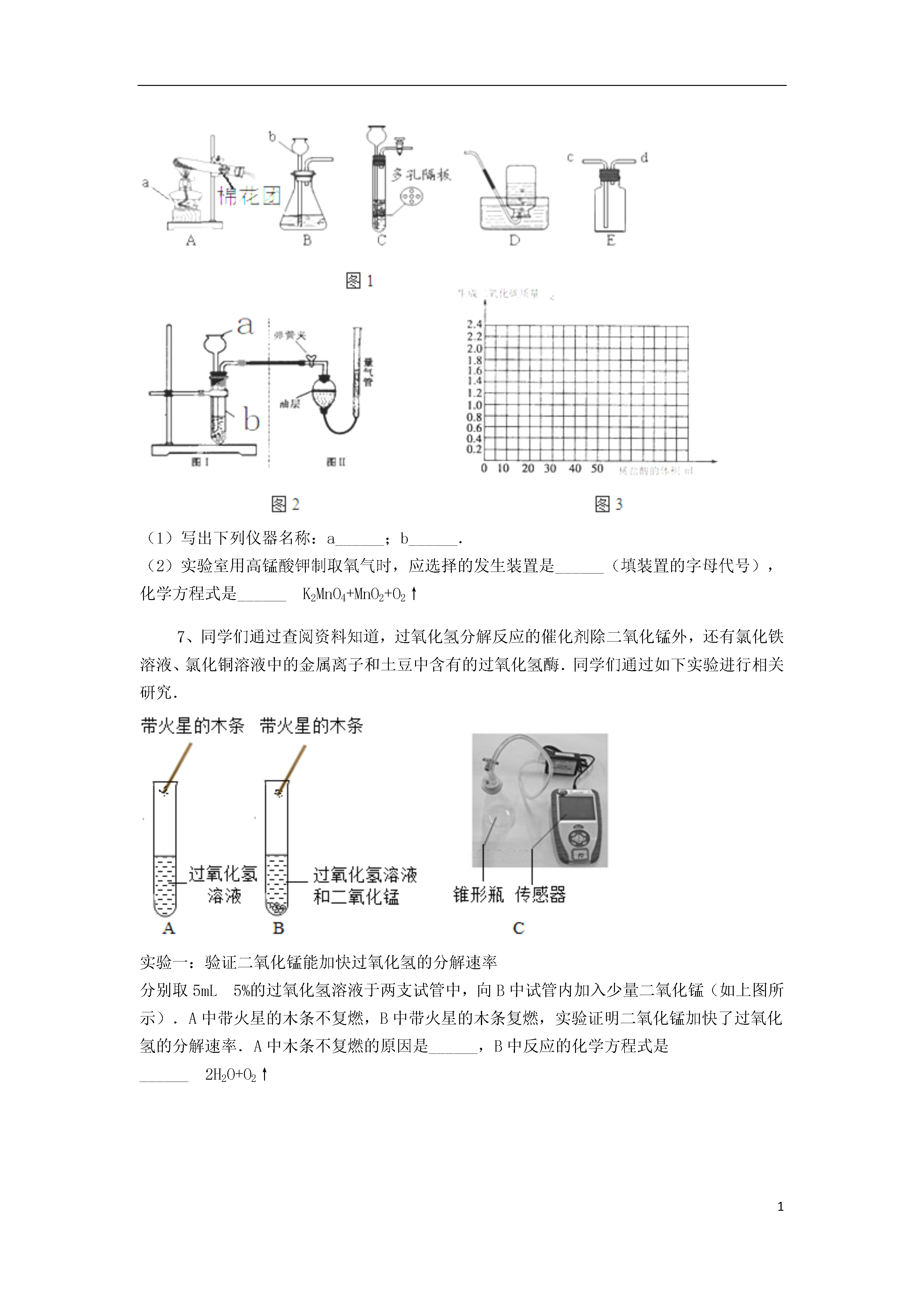
1影响化学反应速率的因素探究231、某兴趣小组同学对实验室制备氧气的条件进行如下探究实验.(1)为探究催化剂的种类对氯酸钾分解速率的影响,甲设计以下对比实验:Ⅰ.将3.0gKClO3与1.0gMnO2均匀混合加热Ⅱ.将xgKClO3与1.0gCuO均匀混合加热在相同温度下,比较两组实验产生O2的快慢.Ⅱ中x的值应是______.(2)探究影响双氧水分解速率的某种因素.①乙的实验数据记录如下:双氧水的质量双氧水的浓度MnO2的质量相同时间内产生O2体积Ⅰ50.0g1%0.1g9mLⅡ50.0g2%0.1g16mLⅢ50.0g4%0.1g31mL本实验中,测量O2体积的装置如图1是______(填字母);实验结论:在相同条件下,______,双氧水分解的速率越快.②丙用图2装置进行实验,通过比较______也能达到实验目的.2、小明同学打算自己探究一下MnO2在分解过氧化氢时所起的作用,但手边没有现成的MnO2药品,只有高锰酸钾,30%过氧化氢溶液、木条、水、火柴,其它仪器可任选.(1)若要先得到MnO2粉末,必需进行的操作是;(2)已知实验(1)中试管中剩下两种物质,其中二氧化锰难溶于水,而另一种易溶于水,小明用了一种方法将它们分离开来,步骤为:①、②.(3)小明认为若要探究MnO2在常温下对分解H2O2有无催化作用,需作对比实验,他设计了三组实验:①在第一支试管中加入5mL30%的过氧化氢溶液,把带火星的木条伸入试管,看木条是否复燃.②…;③在第三支试管中加入5mL30%过氧化氢溶液,并加入少量二氧化锰,把带火星的木条伸入试管,观察木条是否复燃.你认为小明设计的第②组实验过程应为:.(4)小明得到的是③中有O2放出,但有人认为③中有O2放出是因为MnO2与H2O2发生了反应,你如何帮他设计实验来说明MnO2没有和H2O2起反应,而只是起了催化作用?(2分)3、实验室常用下列装置来制取气体:(1)写出图中标号仪器的名称:a______b______;c______;d______;(2)装置B中使用仪器b具有的优点是______;若要检查该装置的气密性,应如何操作______.(3)用双氧水和二氧化锰来制取氧气时,应选用的发生装置是______(填序号),该反应的符号表达式为:______2H2O+O2↑4、化学小组同学对于“金属和硫酸反应的快慢与什么因素有关”的课题开展探究【已有知识】(1)根据金属的活动性顺序,只有排在氢(H)前面的金属才能与稀盐酸或稀硫酸反应制取氢气,且越靠速率越快.(2)实验室制取二氧化碳:当其他因素都相同时,稀盐酸与粉末状石灰石反应速度大于与块状石灰石速率,由此可知化学反应速率快慢与有关.【设计实验】下表是他们分别用相同质量的Fe丝和足量稀硫酸反应的三组实验数据:实验编号硫酸的质量分数/%反应的温度Fe丝消失的时间/S①320500②620300③63080(3)实验②和③表明:该反应快慢与有关.(4)如果实验②反应的温度改为25℃,请推出Fe丝消失的时间(用t表示)的取值范围.【归纳总结】影响金属和稀硫酸反应快慢的因素主要有:反应物的种类,金属颗粒大小,反应温度以及等.【拓展延伸】(5)该实验除了用Fe丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量反应的快慢吗?方法:(6)金属除了能和酸反应外还能和其他金属的盐溶液反应,已知下列各组物质间均能发生置换反应.A.Fe和CuSO4溶液B.Mg和MnSO4溶液C.Mn和FeSO4溶液①写出Fe和CuSO4溶液反应的化学方程式.②Mn、Fe、Mg、Cu四种金属的活动性由弱到强的顺序.5、化学兴趣小组的同学用双氧水和二氧化锰制取氧气,发现反应越来越快,触摸试管外壁有热感.于是提出质疑,双氧水分解速率是否与温度有关?鉴于此,同学们进行了如下实验探究.实验一:探究双氧水分解放热该兴趣小组同学为了探究双氧水分解反应放热,按如图所示的实验装置进行实验.①写出该反应的化学方程式:.②证明反应放热的实验现象是:.③反应开始后用带火星的小木条检验生成气体.带火星的小木条并不复燃,原因是,改进措施为.实验二:探究双氧水分解反应速率与温度有关兴趣小组的同学设计并进行了以下四次实验实验编号H2O2溶液质量分数质量(%)H2O2溶液用量(mL)MnO2用量(g)反应温度(℃)收集气体体积(mL)所需时间(s)1305851003.8215100.1201002.835300.1201007.443055510010.5①上述实验中的对比即可验证双氧水分解反应与温度有关.②由上述实验还可以得出的结论是:.如图1所示为实验室常用的实验

书生****66
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















