



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
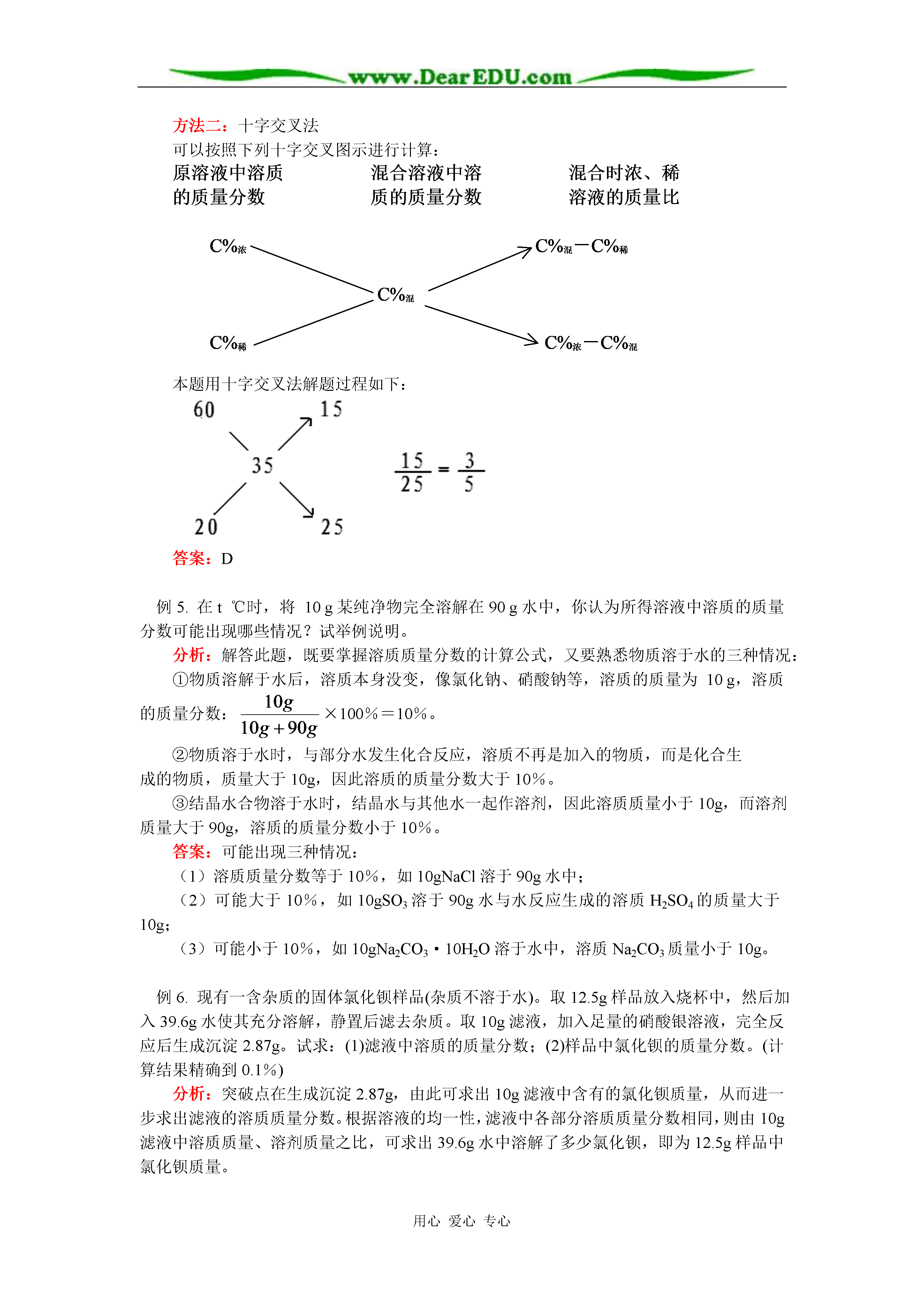
用心爱心专心初三自然科学第一章第五节配制溶液以及有关溶液的计算知识精讲华东师大版【同步教育信息】一.本周教学内容:第一章第五节配制溶液以及有关溶液的计算二.教学目标1.知道溶质质量分数的含义。2.了解配制溶液的一般步骤和操作方法。3.初步掌握有关溶液的计算,会利用溶液的有关概念,根据溶质的质量分数的定义进行溶液的稀释、浓缩以及配制的计算和分析,理解有关溶质的质量分数的简单计算在实践中应用的意义。4.会进行有关化学方程式和溶质的质量分数的综合计算,并将其应用在生产、生活和实验、科研的实际问题的解决之中。三.重点和难点重点:利用溶液的有关概念、根据溶质的质量分数的定义进行溶液的稀释、浓缩以及配制的计算和分析。难点:会进行有关化学方程式和溶质的质量分数的综合计算。四.知识总结溶液是一种或几种物质分散到另一种物质里形成均一、稳定的混合物,在有关溶液的计算中,要准确分析溶质、溶剂、溶液的质量,它们的最基本的质量关系是:溶质质量+溶剂质量=溶液质量1.溶液中溶质的质量分数的基本计算(1)溶液中溶质的质量分数是溶质质量与溶液质量之比。可用下式表示:注意:①溶液中溶质的质量分数的数值大小,表示溶液的浓、稀程度;②算式中溶质质量是指实际溶解的溶质质量,不包括未溶解的溶质的质量;③结晶水合物溶于水得到的溶液中,溶质是无水化合物;④酸性氧化物或碱性氧化物溶于水时,与水发生化合反应,所得溶液中的溶质是对应的生成物——酸或碱。如CaO+H2O=Ca(OH)2,其溶质为Ca(OH)2;(2)溶液质量与溶液密度的联系:溶液的质量(g)=溶液的体积(ml)×溶液的密度(g/ml)(3)饱和溶液中溶质的质量分数可以用下式表示:溶质质量分数=×100%2.有关浓溶液加水稀释的计算M浓×c%浓=M稀×c%稀(由浓溶液与稀溶液中溶质的质量相等导出,这里的浓溶液和稀溶液只是相对而言)M稀=M浓+M水(但是稀溶液的体积不等于浓溶液的体积与水的体积之和)所以:M浓×c%浓=(M浓+M水)×c%稀3.有关溶液加浓的计算(1)蒸发水分使稀溶液变为浓溶液M浓×c%浓=M稀×c%稀M浓=M稀-M水所以:(M稀-M水)×c%浓=M稀×c%稀(2)加入同种溶质使稀溶液变为浓溶液M浓=M稀+M溶质所以:M溶质+M稀×c%稀=(M稀+M溶质)×c%浓4.同一种溶质,但是溶液中溶质的质量分数不同的溶液,进行混合时的计算M浓×c%浓+M稀×c%稀=M混×c%混又M混=M浓+M稀所以:M浓×c%浓+M稀×c%稀=(M浓+M稀)×c%混5.溶液中溶质的质量分数与化学方程式的综合计算这一类计算,可以根据化学方程式求出溶液中溶质的质量原则:代入化学方程式计算的数据必须是纯物质的质量。要求认真审题,充分挖掘题目所给的信息,根据已知条件,找到解题的突破点,再按照题目设问求解。反应后所得溶液的质量=反应前各溶液质量总和-生成气体(或沉淀)的质量6.配制一定溶质的质量分数的溶液(1)实验主要仪器:托盘天平、量筒、烧杯、玻璃棒、药匙、胶头滴管等(2)实验操作步骤:①计算——溶质的质量、溶剂的体积②称量——称溶质的质量,量溶剂的体积③溶解——先放入固体后加入液体,玻璃棒搅拌加快溶解的速度【典型例题】例1.农业生产上,常用10%~20%的氯化钠溶液选种,以选择饱满的种子及减少农作物病毒害的发生。现在需要配制16%的氯化钠溶液500kg,计算需要氯化钠和水各多少千克?分析:已知NaCl溶液中溶质的质量分数和NaCl溶液的质量,可以利用公式:溶质的质量=溶液的质量×溶质的质量分数溶剂的质量=溶液的质量-溶质的质量来求出NaCl和水的质量。(本题计算时可直接用kg这一单位)500kg×16%=80kg500kg-80kg=420kg或500kg×(1-16%)=420kg答案:需要NaCl80kg,水420kg。例2.配制100g溶质的质量分数为10%的稀盐酸,需要溶质的质量分数为37%的浓盐酸和水各多少毫升?(37%浓盐酸的密度为1.19g/ml)分析:将37%的浓盐酸加水使之变成10%的稀盐酸,这是溶液稀释问题,解这类题目时要紧紧抓住稀释前后溶液中溶质的质量不变这一关键,去进行思考和列式。本题还要注意在求出浓盐酸和水的质量之后,要通过密度将液体的质量换算成体积。解:设需要37%的浓盐酸的质量为x100g×10%=37%xx=27g需要水的质量:100g-27g=73g浓盐酸的体积==22.7ml水的体积==73ml答案:需要37%的浓盐酸22.7ml,水73ml.例3.现有溶质的质量分数为10%的NaOH溶液100g,要让其溶质的质量分数增大一倍,

雨星****萌娃
 实名认证
实名认证
 内容提供者
内容提供者
最近下载
最新上传
高平市第一中学2023年高三综合题(三)物理试题.doc
鄂尔多斯市第一中学2022-2023学年高三3月份两校联考物理试题.doc
迪庆市重点中学2023届高考物理试题命题比赛模拟试卷(31).doc
赣州市红旗实验中学2023届高三下学期第一次模拟-物理试题试卷.doc
福建莆田秀屿下屿中学2023年高三高考考前指导卷(2)物理试题.doc
福建省龙海市第二中学2023年高三下学期第一次适应性考试物理试题.doc
福建省龙岩高中2023届高三第三次教学质量监测物理试题试卷.doc
福建省龙岩市龙岩第一中学2023届高三3月新起点考试物理试题.doc
福建省龙岩市龙岩一中2022-2023学年5月高三联考物理试题试卷.doc
福建省龙岩市长汀县新桥中学2023年下学期高三联考物理试题.doc


















