



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
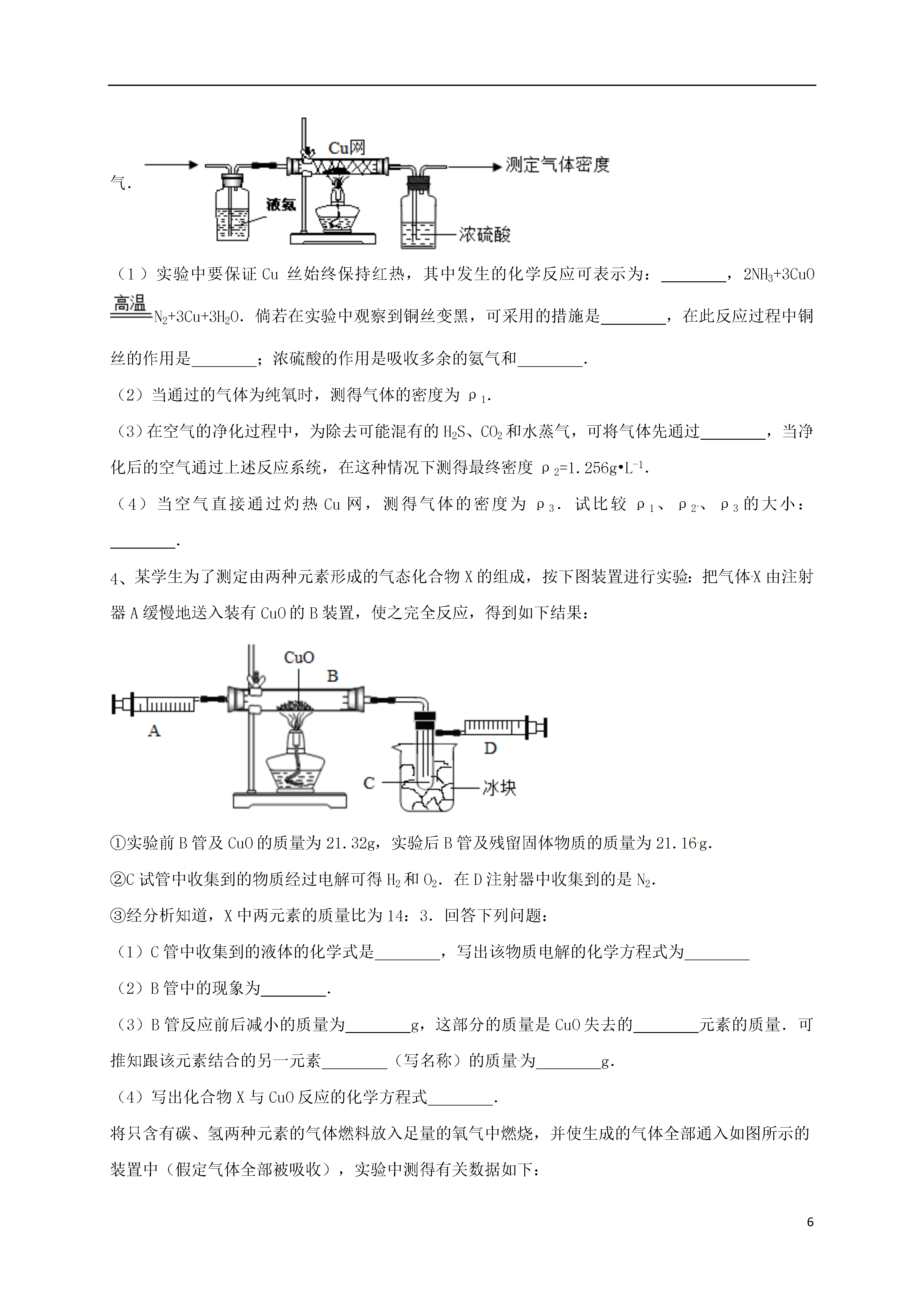
6常用气体的收集方法13如图是老师放置在实验桌上的三瓶无色气体,它们可能是H2、O2、CO2.下列关于这三种气体的鉴别方法中,不正确的是()A.根据瓶③倒置,可判断瓶③存放的是H2B.用带火星的木条放入①中,若复燃,则存放的是O2C.用点燃的木条伸入②中,若火焰熄灭,则存放的是CO2D.向②中加入少量蒸馏水,若变为红色,则存放的是CO2工业城市的酸雨,主要是由含硫量高的煤大量燃烧排放二氧化硫形成的.实验小组查阅资料发现“二氧化硫和二氧化碳一样,能使紫色石蕊试液变红,也能使澄清石灰水变浑浊.”于是对二氧化硫展开探究:探究问题一:二氧化硫能使紫色石蕊试液变红的原因.实验探究:取四朵用石蕊试液染成紫色的干燥纸花,按下表方案进行实验.序号实验方案和现象实验结论1在一朵纸花上喷少量稀盐酸,纸花变红酸能使紫色石蕊变红2在一朵纸花上喷少量蒸馏水,纸花不变色水、二氧化硫气体不能使紫色石蕊变红3将一朵纸花直接放入盛有二氧化硫的集气瓶中,纸花______色.(填“变”或“不变”)4____________探究问题二:验证煤燃烧生成二氧化硫和二氧化碳.查阅资料:二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色).进行试验:实验小组进行了如图所示实验(部分装置在图中略去):探究与结论:(1)证明煤燃烧生成二氧化硫的现象是______.(2)D中反应的化学方程式是______.(3)上图C装置的作用是______.有一种矿石称为“孔雀石”,它有孔雀羽毛般绿色斑纹,它的主要成分是碱式碳酸铜[Cu2(OH)2CO3].因碱式碳酸铜中含有铜元素,某兴趣小组同学对如何从孔雀石中提炼金属铜产生了浓厚兴趣,为此采集了适量的孔雀石样品,在老师的指导下进行了下列探究活动.(1)经查阅资料,已知碱式碳酸铜具有下列性质,你认为其中属于化学性质的是A.绿色固体B.不溶于水D.加热碱式碳酸铜会生成水、二氧化碳和氧化铜(2)加热孔雀石样品使之分解,其反应的化学方程式是应选用下列(填装置的序号)装置,其理由是.兴趣小组根据初中课本“木炭还原氧化铜”原理进一步实验得到红色金属铜,请写出该反应的化学方程式:(3)检验生成的气体中是否含有CO2需要用到的化学试剂名称是;观察到时,证明实验中有CO2产生.该反应的化学方程式是.19世纪末,英国科学家瑞利在对气体密度(通常在混合气体中,相对分子质量大的气体的体积分数越大,则混合气体的平均密度就越大)进行测定的工作中,发现以不同来源的N2进行测定时,会出现不能消除的微小误差,从而导致了稀有气体的发现.在实验中,瑞利利用了如下图所示的实验系统(箭头表示气体流向),通过的气体是经过净化处理的纯氧气或空气.(1)实验中要保证Cu丝始终保持红热,其中发生的化学反应可表示为:,2NH3+3CuON2+3Cu+3H2O.倘若在实验中观察到铜丝变黑,可采用的措施是,在此反应过程中铜丝的作用是;浓硫酸的作用是吸收多余的氨气和.(2)当通过的气体为纯氧时,测得气体的密度为ρ1.(3)在空气的净化过程中,为除去可能混有的H2S、CO2和水蒸气,可将气体先通过,当净化后的空气通过上述反应系统,在这种情况下测得最终密度ρ2=1.256g•L-1.(4)当空气直接通过灼热Cu网,测得气体的密度为ρ3.试比较ρ1、ρ2、ρ3的大小:.某学生为了测定由两种元素形成的气态化合物X的组成,按下图装置进行实验:把气体X由注射器A缓慢地送入装有CuO的B装置,使之完全反应,得到如下结果:①实验前B管及CuO的质量为21.32g,实验后B管及残留固体物质的质量为21.16g.②C试管中收集到的物质经过电解可得H2和O2.在D注射器中收集到的是N2.③经分析知道,X中两元素的质量比为14:3.回答下列问题:(1)C管中收集到的液体的化学式是,写出该物质电解的化学方程式为(2)B管中的现象为.(3)B管反应前后减小的质量为g,这部分的质量是CuO失去的元素的质量.可推知跟该元素结合的另一元素(写名称)的质量为g.(4)写出化合物X与CuO反应的化学方程式.将只含有碳、氢两种元素的气体燃料放入足量的氧气中燃烧,并使生成的气体全部通入如图所示的装置中(假定气体全部被吸收),实验中测得有关数据如下:实验前实验后干燥剂+U形管101.3g103.1g石灰水+广口瓶313.0g315.2g根据实验数据填写下列各空白处:(1)实验结束后生成物中水的质量为______,二氧化碳的质量为______.(2)生成的水中氢元素的质量为______,二氧化碳中碳元素的质量为______.(3)该燃料

Ch****91
 实名认证
实名认证
 内容提供者
内容提供者
最近下载
最新上传
高平市第一中学2023年高三综合题(三)物理试题.doc
鄂尔多斯市第一中学2022-2023学年高三3月份两校联考物理试题.doc
迪庆市重点中学2023届高考物理试题命题比赛模拟试卷(31).doc
赣州市红旗实验中学2023届高三下学期第一次模拟-物理试题试卷.doc
福建莆田秀屿下屿中学2023年高三高考考前指导卷(2)物理试题.doc
福建省龙海市第二中学2023年高三下学期第一次适应性考试物理试题.doc
福建省龙岩高中2023届高三第三次教学质量监测物理试题试卷.doc
福建省龙岩市龙岩第一中学2023届高三3月新起点考试物理试题.doc
福建省龙岩市龙岩一中2022-2023学年5月高三联考物理试题试卷.doc
福建省龙岩市长汀县新桥中学2023年下学期高三联考物理试题.doc


















