
如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
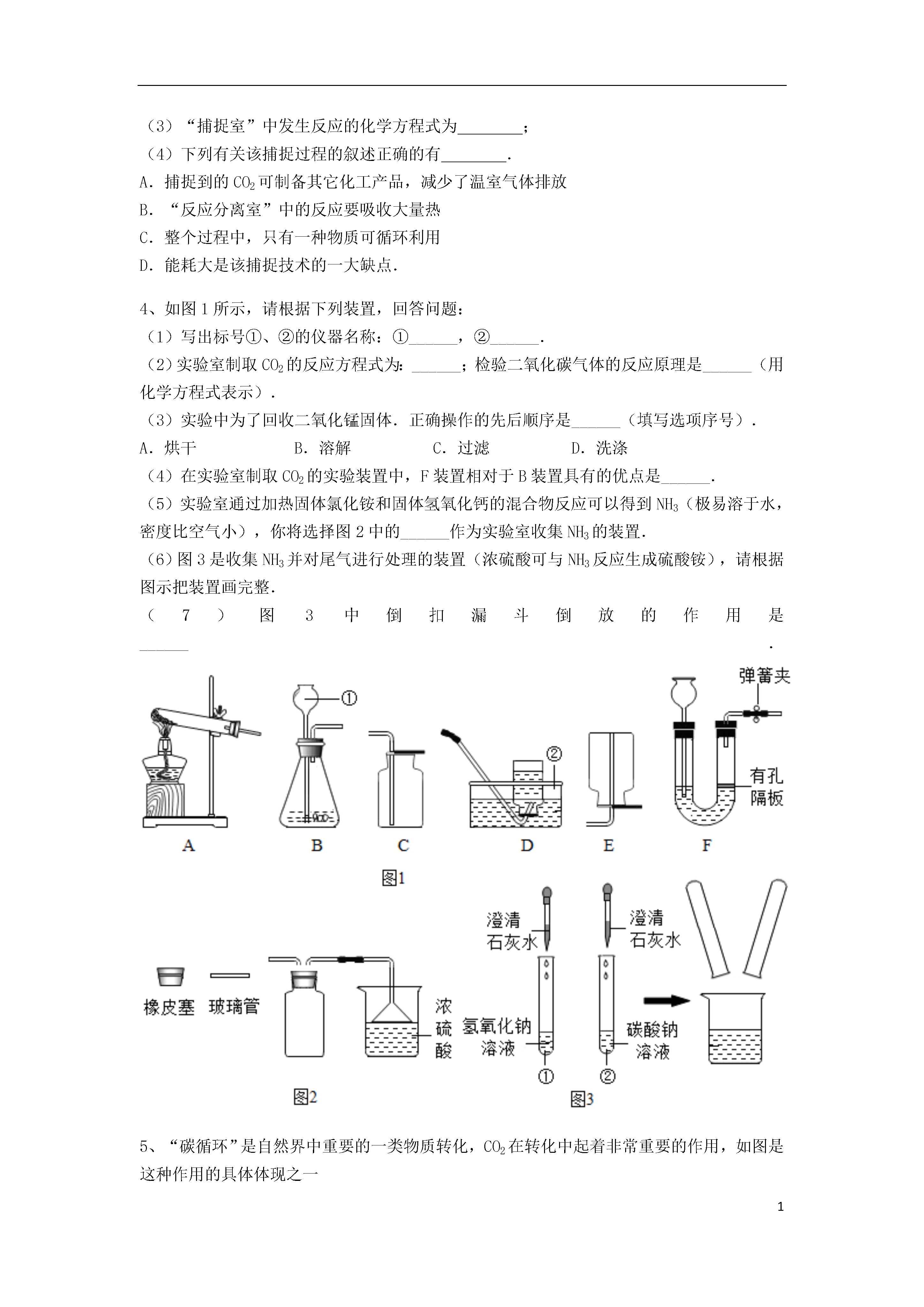
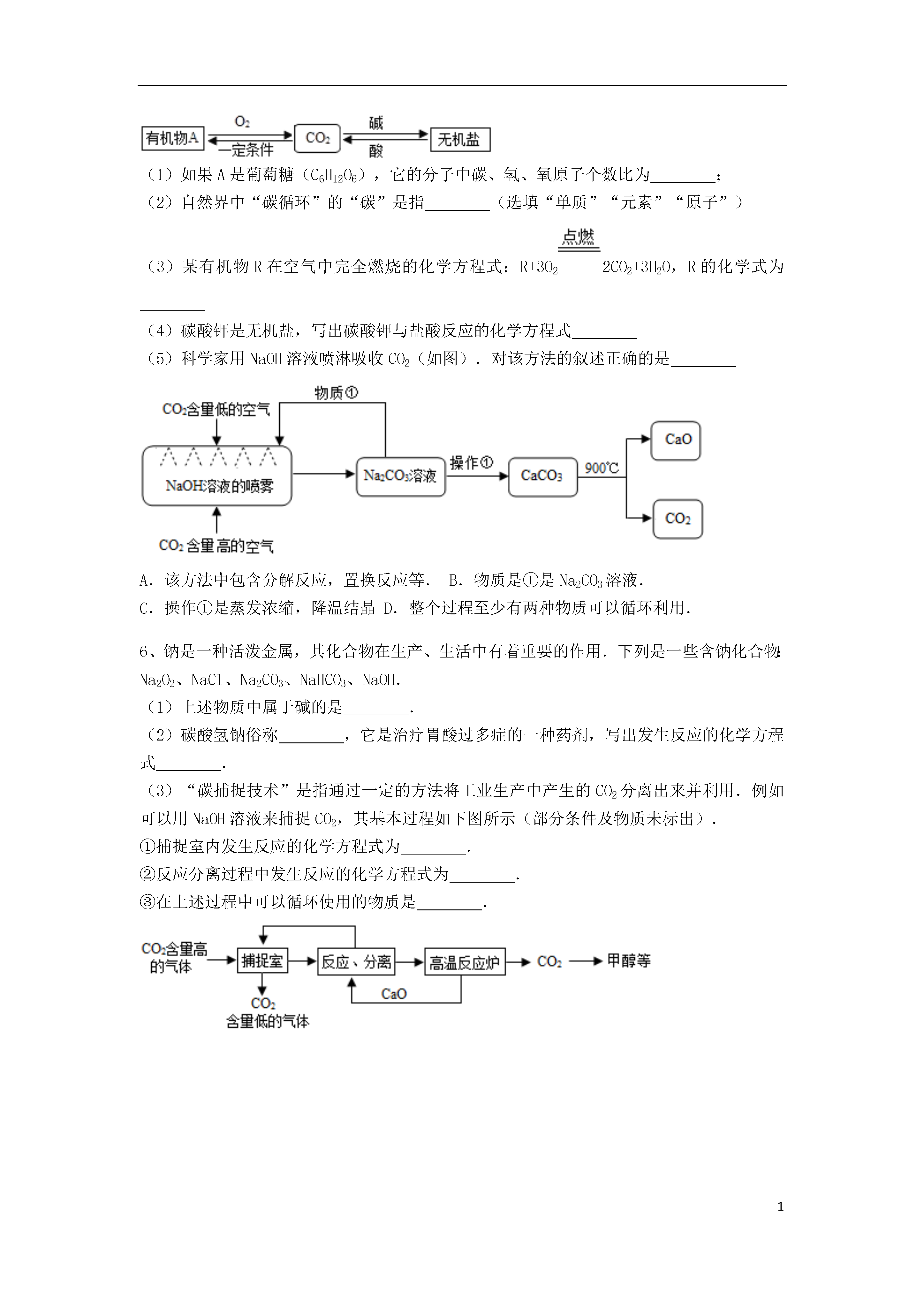
1混合物的分离方法22实验室用下图装置进行CO与CO2的分离和对比实验.其中甲瓶盛足量的NaOH溶液,乙瓶盛有澄清石灰水,分液漏斗(丙)盛稀硫酸.(1)关闭B,打开A时,甲中发生反应的化学方程式是______;当乙中的现象是______时,则证明CO2已被完全吸收,且CO也已收集满.(2)关闭A,按乙瓶起始的状态再更换另一个广口瓶,当观察到乙中出现浑浊现象时,说明已进行的实验操作是______,甲中发生反应的化学方程式是______,过一段时间,乙中的浑浊现象消失,成为无色溶液,其原因是生成了能溶于水的碳酸氢钙[Ca(HCO3)2],该反应的化学方程式是______.如图是分离与提纯海水的流程,下列有关认识错误的是()A.常用于淡化海水的方法有蒸馏法、过滤法、高分子膜分离法等B.粗盐提纯为较纯净的食盐晶体的操作为:溶解、过滤、蒸发C.通常在苦卤中加入熟石灰制取氢氧化镁D.海水中的氯化钠用途广泛,例如工业上利用氯化钠为原料来制取纯碱工业上用“碳捕捉”技术将CO和CO2混合气体的CO2反应,并得到CO,其基本过程如图所示(部分条件及物质示未标出):O和CO2(1)反应②分离出的CO2可制成干冰,干冰常用于;(2)反应①在“反应分离室”内进行,其中发生反应的化学方程式为.将NaOH溶液和CaCO3分离的操作是;(3)“捕捉室”中发生反应的化学方程式为;(4)下列有关该捕捉过程的叙述正确的有.A.捕捉到的CO2可制备其它化工产品,减少了温室气体排放B.“反应分离室”中的反应要吸收大量热C.整个过程中,只有一种物质可循环利用D.能耗大是该捕捉技术的一大缺点.如图1所示,请根据下列装置,回答问题:(1)写出标号①、②的仪器名称:①______,②______.(2)实验室制取CO2的反应方程式为:______;检验二氧化碳气体的反应原理是______(用化学方程式表示).(3)实验中为了回收二氧化锰固体.正确操作的先后顺序是______(填写选项序号).A.烘干B.溶解C.过滤D.洗涤(4)在实验室制取CO2的实验装置中,F装置相对于B装置具有的优点是______.(5)实验室通过加热固体氯化铵和固体氢氧化钙的混合物反应可以得到NH3(极易溶于水,密度比空气小),你将选择图2中的______作为实验室收集NH3的装置.(6)图3是收集NH3并对尾气进行处理的装置(浓硫酸可与NH3反应生成硫酸铵),请根据图示把装置画完整.(7)图3中倒扣漏斗倒放的作用是______.“碳循环”是自然界中重要的一类物质转化,CO2在转化中起着非常重要的作用,如图是这种作用的具体体现之一(1)如果A是葡萄糖(C6H12O6),它的分子中碳、氢、氧原子个数比为;(2)自然界中“碳循环”的“碳”是指(选填“单质”“元素”“原子”)(3)某有机物R在空气中完全燃烧的化学方程式:R+3O22CO2+3H2O,R的化学式为(4)碳酸钾是无机盐,写出碳酸钾与盐酸反应的化学方程式(5)科学家用NaOH溶液喷淋吸收CO2(如图).对该方法的叙述正确的是A.该方法中包含分解反应,置换反应等.B.物质是①是Na2CO3溶液.C.操作①是蒸发浓缩,降温结晶D.整个过程至少有两种物质可以循环利用.钠是一种活泼金属,其化合物在生产、生活中有着重要的作用.下列是一些含钠化合物:Na2O2、NaCl、Na2CO3、NaHCO3、NaOH.(1)上述物质中属于碱的是.(2)碳酸氢钠俗称,它是治疗胃酸过多症的一种药剂,写出发生反应的化学方程式.(3)“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.例如可以用NaOH溶液来捕捉CO2,其基本过程如下图所示(部分条件及物质未标出).①捕捉室内发生反应的化学方程式为.②反应分离过程中发生反应的化学方程式为.③在上述过程中可以循环使用的物质是.
Ta的资源

2025年衡阳市衡山县人力资源管理师二级理论知识深度预测试卷含解析

2025年衡阳市衡山县二级建造师考试水利水电工程管理与实务统考试题含解析

2025年衡水市阜城县二级建造师考试水利水电工程管理与实务临考冲刺试题含解析

2025年衡阳市衡南县二级建造师考试水利水电工程管理与实务临考冲刺试卷及答案

2025年衡水市桃城区人力资源管理师二级理论知识考前冲刺预测试卷完整版

2025年衡水市桃城区二级建造师考试水利水电工程管理与实务考前冲刺预测试卷完整版

2025年衡水市枣强县人力资源管理师四级理论知识考前冲刺试题含解析

2025年衡水市桃城区二级建造师考试水利水电工程管理与实务预测试卷(附答案及解析)

2025年衡水市枣强县二级建造师考试水利水电工程管理与实务押题密卷及答案

2025年行唐县人力资源管理师二级理论知识高分冲刺试卷(附答案及解析)

书生****ma
 实名认证
实名认证
 内容提供者
内容提供者
最近下载
最新上传
2025年衡阳市衡阳县人力资源管理师四级理论知识考前冲刺试卷(附答案及解析).docx
2025年衡阳市衡阳县人力资源管理师四级理论知识考前冲刺试题(附答案及解析).docx
2025年衢州市常山县二级建造师考试水利水电工程管理与实务临考冲刺试卷完整版.docx
2025年衡阳市衡阳县人力资源管理师四级理论知识考前冲刺预测试卷及答案.docx
2025年衡阳市衡阳县人力资源管理师四级理论知识预测密卷及答案.docx
2025年衡阳市衡阳县人力资源管理师四级理论知识预测试卷及答案.docx
2025年衡阳市衡阳县人力资源管理师四级理论知识高分冲刺试题含解析.docx
2025年衡阳市衡阳县人力资源管理师四级理论知识高分通关卷完整版.docx
2025年衡阳市衡阳县人力资源管理师四级理论知识统考试题(附答案及解析).docx
2025年衡阳市衡阳县人力资源管理师四级理论知识高分通关卷含解析.docx








