


如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
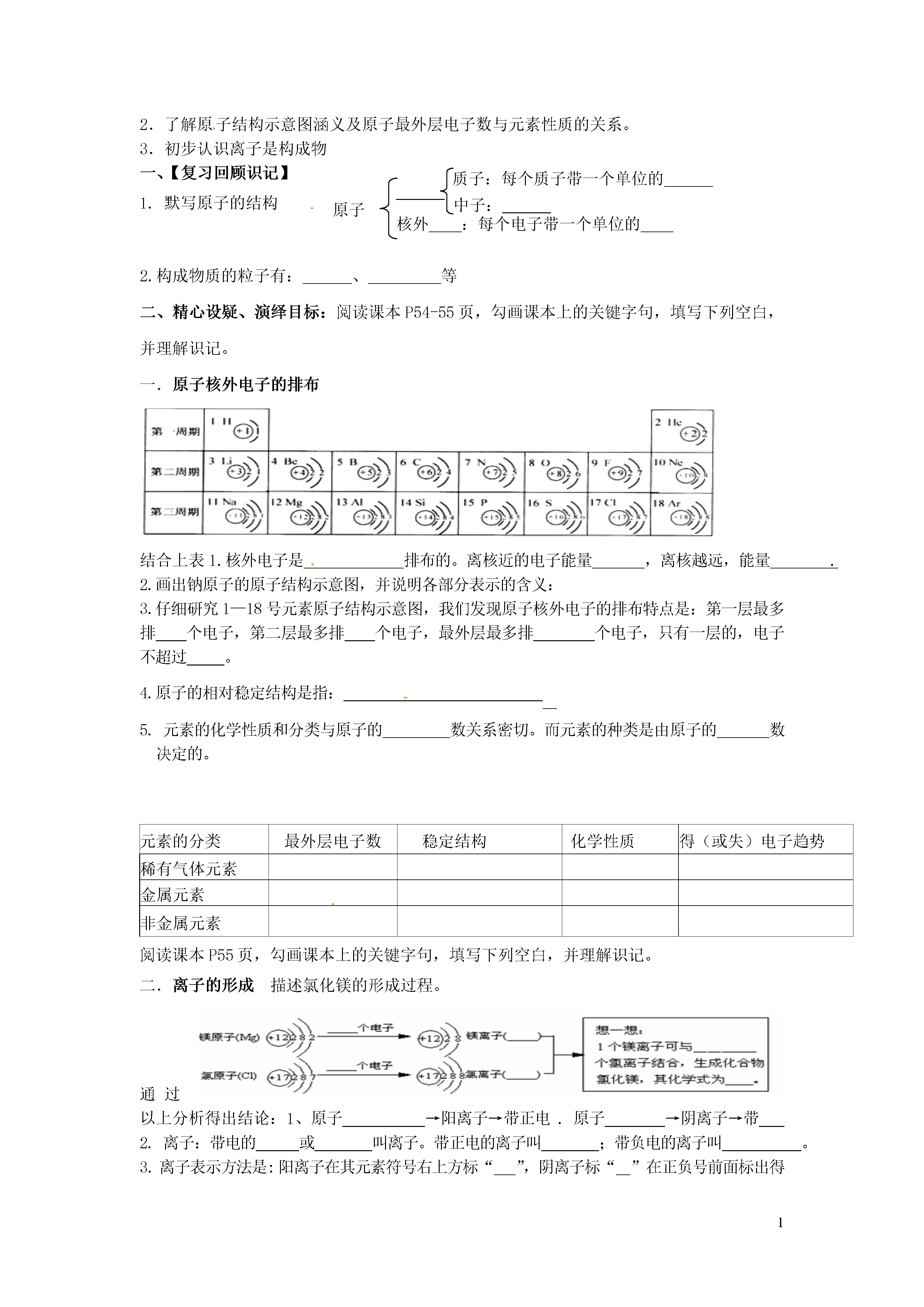
1原子的结构【学习目标】1.能说出构成原子的各种粒子以及带电情况。2.能说出原子内空间和质量分布情况。3.知道相对原子质量表示的意义,会查相对原子质量。一、【复习回顾识记】1.根据元素名称,默写元素符号:氦氖硅氩钙锰银钠镁铝锌铁铜金氯汞钡铂2.分子是保持物质的最小微粒。原子是的最小粒子3.分子和原子本质的区别是二、精心设疑、演绎目标阅读课本P53页和56页,勾画课本上的关键字句,填写下列空白,并理解识记。一.原子的构成1.原子是(填“可以”、“不可以”)再分的。由于原子是的最小粒子,所以原子在中不可以再分。2.原子是由居于原子带电的和带电的构成的,原子核是由和构成的,构成原子的三种粒子是:(正电)、(不带电)、(带负电)。(注意特例:一般的氢原子无。)由于原子核所带电量和核外电子所带的,因此整个原子。原子的质量主要集中在,这是因为和的质量几乎相等,而一个电子的质量只相当于一个质子质量的1/1836,可忽略不计。3.在原子中:数〓数〓数。(填一定或不一定)等于中子数4.原子核很小,原子核外有很的空间。电子在核外作二.相对原子质量1.相对原子质量:是以一种(碳-12)质量的1/12作为标准,其他跟相比较所得的,作为这种原子的相对原子质量(符号为)。如果用算式表示,可以表示为:相对原子质量=。相对原子质量的单位为.一般不写出来粒子种类电性质量质子1个单位正电荷1.6726×10-27kg中子不带电1.6749×10-27kg电子1个单位负电荷质子质量的1/18363.根据表3-1中的信息,你能得出哪些结论?四、分组展示、归纳小结各小组交流自学成果;合作解决自学问题;五、例题精炼、拓展升华知识点一、原子的构成1、2011年3月11日,日本发生9.0级地震,造成福岛核电站放射性物质泄漏,在其附近水域已经检测到放射性物质碘131。已知碘131原子的原子核电荷数为53,质子数与中子数之和为131。下列有关这种碘原子的说法中,不正确的是()A.核外电子数为53B.相对原子质量为131C.质子数为53D.中子数为34知识点二、相对原子质量2、原子中决定相对原子质量大小的主要微粒是()A、质子数和电子数B、核电荷数C、中子数和电子数D、质子数和中子数六、反馈练习,体验成功1.课本P58页第2题2.我国著名化学家张青莲教授与另一位科学家合作,测定了铟元素的相对原子质量新值。铟元素的核电荷数为49,相对原子质量为115。铟原子的核外电子数为()A.115B.49C.66D.1645、将①分子②原子③质子④中子⑤电子等粒子用序号分别填入下列适当空格中:(1)构成物质的基本粒子是(2)构成原子的基本粒子是(3)显示电中性的粒子是(4)带正电的粒子是(5)参加化学反应一定发生变化的粒子是(6)原子中数目一定相等的粒子是【快乐心得】我的收获有:课题:2原子的结构课时:1授课时间:学生姓名:【学习目标】1.知道原子核外电子是分层排布的。知道原子结构的表示方法2.了解原子结构示意图涵义及原子最外层电子数与元素性质的关系。3.初步认识离子是构成物原子核外:每个电子带一个单位的质子:每个质子带一个单位的中子:一、【复习回顾识记】1.默写原子的结构2.构成物质的粒子有:、等二、精心设疑、演绎目标:阅读课本P54-55页,勾画课本上的关键字句,填写下列空白,并理解识记。一.原子核外电子的排布结合上表1.核外电子是排布的。离核近的电子能量,离核越远,能量.2.画出钠原子的原子结构示意图,并说明各部分表示的含义:3.仔细研究1—18号元素原子结构示意图,我们发现原子核外电子的排布特点是:第一层最多排个电子,第二层最多排个电子,最外层最多排个电子,只有一层的,电子不超过。4.原子的相对稳定结构是指:5.元素的化学性质和分类与原子的数关系密切。而元素的种类是由原子的数决定的。元素的分类最外层电子数稳定结构化学性质得(或失)电子趋势稀有气体元素金属元素非金属元素阅读课本P55页,勾画课本上的关键字句,填写下列空白,并理解识记。二.离子的形成描述氯化镁的形成过程。通过以上分析得出结论:1、原子→阳离子→带正电.原子→阴离子→带2.离子:带电的或叫离子。带正电的离子叫;带负电的离子叫。3.离子表示方法是:阳离子在其元素符号右上方标“”,阴离子标“”在正负号前面标出得或失的(即离子所带的电荷数),电子数为1时,“1”必须省略。4.离子符号的意义:表示一个什么离子带多少个单位的正(负)电荷如:Mg2+表示,Cl-表示.离子符号前面的系数表示离子个数.如:2Mg2+表示.5.构成物质的粒子有:、、三、点拨

努力****星驰
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















