


如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
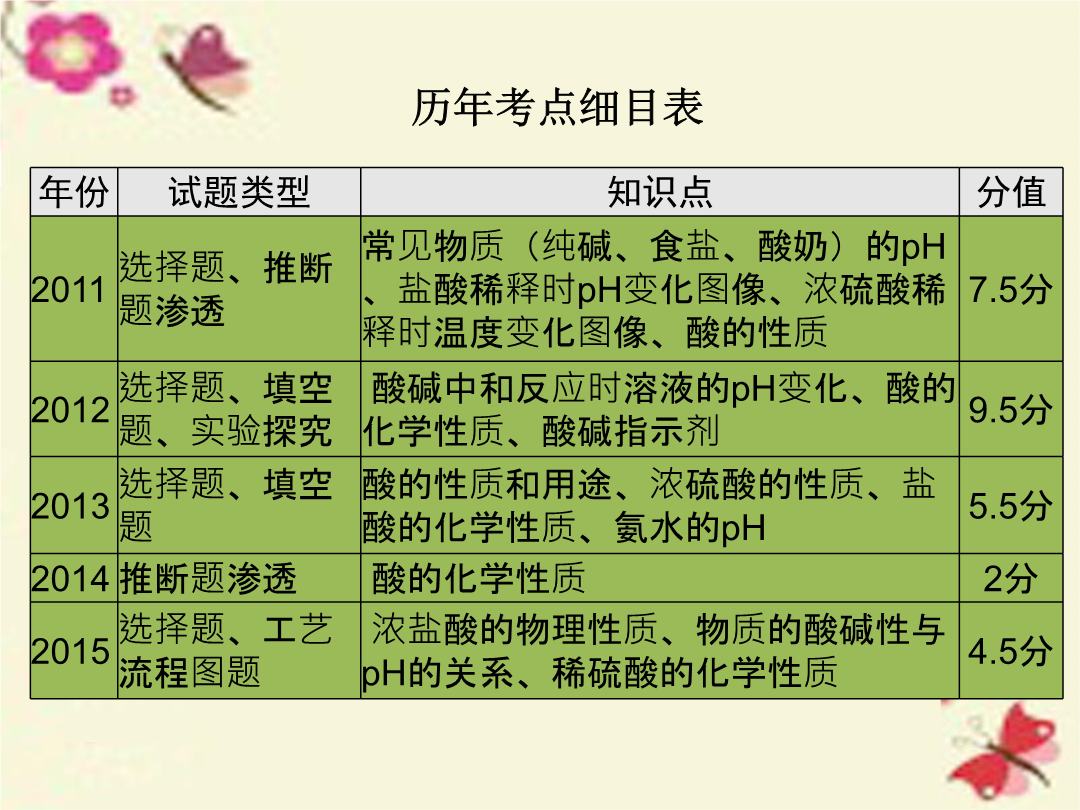
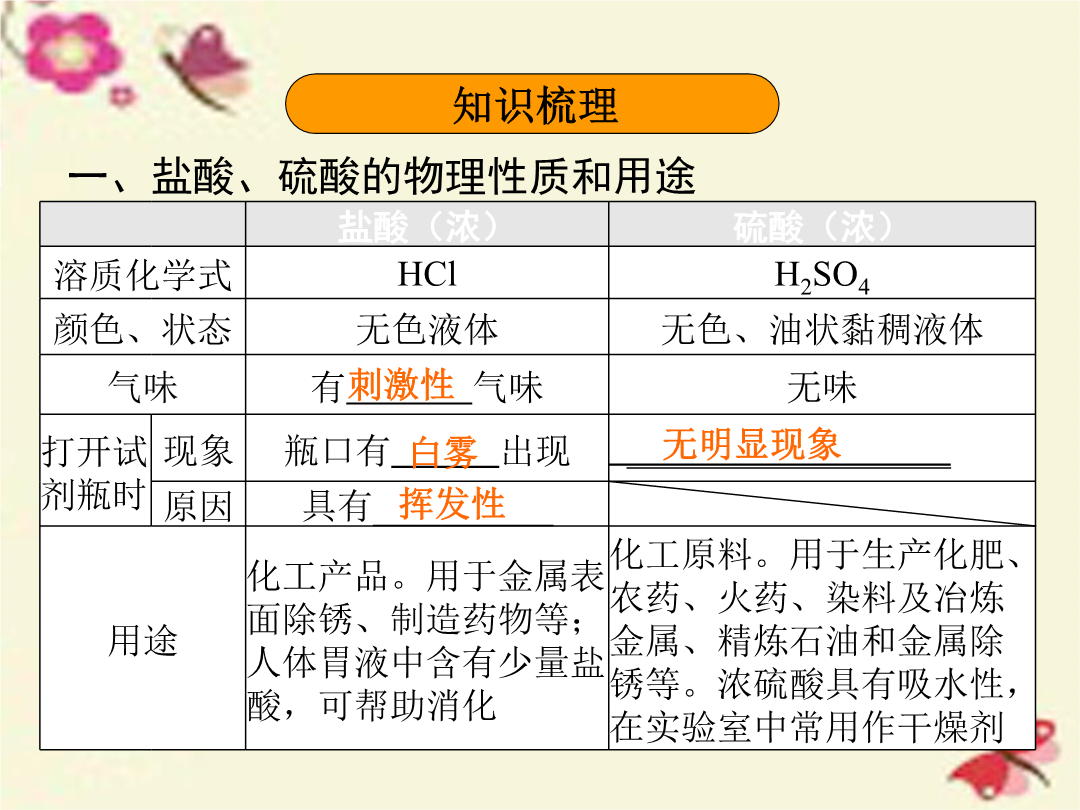
第十二单元常见的酸和pH历年考点细目表二、浓硫酸的特性和稀释1.浓硫酸的特性(1)吸水性:浓硫酸具有吸水性,敞口放置在空气中质量将增加,需要密封保存。(2)腐蚀性:浓硫酸能夺取纸张、木材、布料、皮肤里的水分,生成黑色的炭(这种作用通常叫做脱水作用)。有强烈的腐蚀性,如不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。2.常见酸碱指示剂在不同性质溶液中的颜色变化5.如果不断加水把某硫酸溶液稀释,则硫酸溶液的pH与加水量关系图正确的是()6.(2015·自贡改编)硫酸和盐酸是实验室常用的试剂,也是重要的化工原料,它们既有相似之处,又有不同之点。(1)它们水溶液的pH都(填“>”“=”或“<”)7,它们都能使紫色石蕊试液变成。(2)它们都能除铁锈,写出盐酸与铁锈的主要成分反应的化学方程式:。(3)它们都能与活泼金属反应放出氢气,写出铁与稀硫酸反应的化学方程式:。(4)打开两瓶分别盛有浓硫酸和浓盐酸的试剂瓶,瓶口出现白雾的是盛有的试剂瓶。防错妙招熟练掌握浓硫酸和浓盐酸的特性,浓盐酸的挥发性,浓硫酸的腐蚀性、吸水性,同时特性和现象要一一对应。(1)浓盐酸有挥发性,故打开浓盐酸试剂瓶时瓶口处会产生白雾;浓盐酸敞口放置在空气中,溶质质量、溶液质量和溶质质量分数均会减小。(2)浓硫酸具有吸水性,敞口放置在空气中,溶质质量不变,溶液质量增大,溶质质量分数减小;利用浓硫酸的吸水性可以干燥某些气体。(3)浓硫酸具有强烈的腐蚀性,可以夺取纸张、木材、布料、皮肤里的水分,生成黑色的炭。实验一溶液酸碱性的检验1.自制酸碱指示剂:选择植物的花瓣或果实,在研钵中捣烂,加入浸泡,用纱布将浸泡出的汁液过滤或挤出。2.测定溶液的pH(1)实验步骤:在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与比较,读出该溶液的pH。例1(2015·南昌)某校同学开展了如下“溶液酸碱性的检验”的实验活动:(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:①图1中存放紫薯汁的仪器名称。②据上表推测,紫薯汁遇到稀硫酸溶液可能显示的颜色是,该汁液(填“能”或“不能”)做酸碱指示剂。实验二酸的性质验证实验1.与酸碱指示剂作用(1)实验操作:在点滴板上滴上稀盐酸、稀硫酸,分别滴入紫色石蕊和无色酚酞试液。(2)实验现象:2.与金属氧化物反应(1)实验操作:向装有铁锈、氧化铜的试管中分别滴入稀盐酸和稀硫酸,观察现象。(2)实验现象:过考点1.C2.D3.A4.(1)③Fe2O3+6HCl====2FeCl3+3H2O(合理即可)④2NaOH+H2SO4====Na2SO4+2H2O(合理即可)⑤与某些盐反应(2)②可除去铁锈(答案合理即可)(3)氢离子(或H+)5.B6.(1)木棍变黑(2)浓硫酸具有吸水性,吸收空气中的水蒸气,浓硫酸溶于水放热(3)用大量的水冲洗(4)①量取②浓硫酸搅拌,防止局部过热7.B8.C9.(1)<(2)ACE(3)甲,用滴管吸取液体时,应先捏扁胶头赶尽气体,再伸入试剂瓶中吸液(或乙,滴管应放在洁净的烧杯内;丙,滴瓶上的滴管用后应不经洗涤直接放回原滴瓶;丁,应将滴管尖口向下)(4)节约药品10.(1)盐酸具有挥发性,挥发出的氯化氢气体使制得的氢气不纯(2)红色固体逐渐减少,溶液变成黄色(3)NaOH+HCl====NaCl+H2O(或2NaOH+H2SO4====Na2SO4+2H2O)(4)D(5)A直击广东中考1.(1)√(2)×(3)√(4)√(5)√2.C3.B4.>5.BaCl26.(1)紫色石蕊溶液(2)CaO+H2SO4====CaSO4+H2O(或CaO+H2O====Ca(OH)2、Ca(OH)2+H2SO4====CaSO4+2H2O)7.Fe2O3+3H2SO4====Fe2(SO4)3+3H2O

是你****深呀
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















