



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
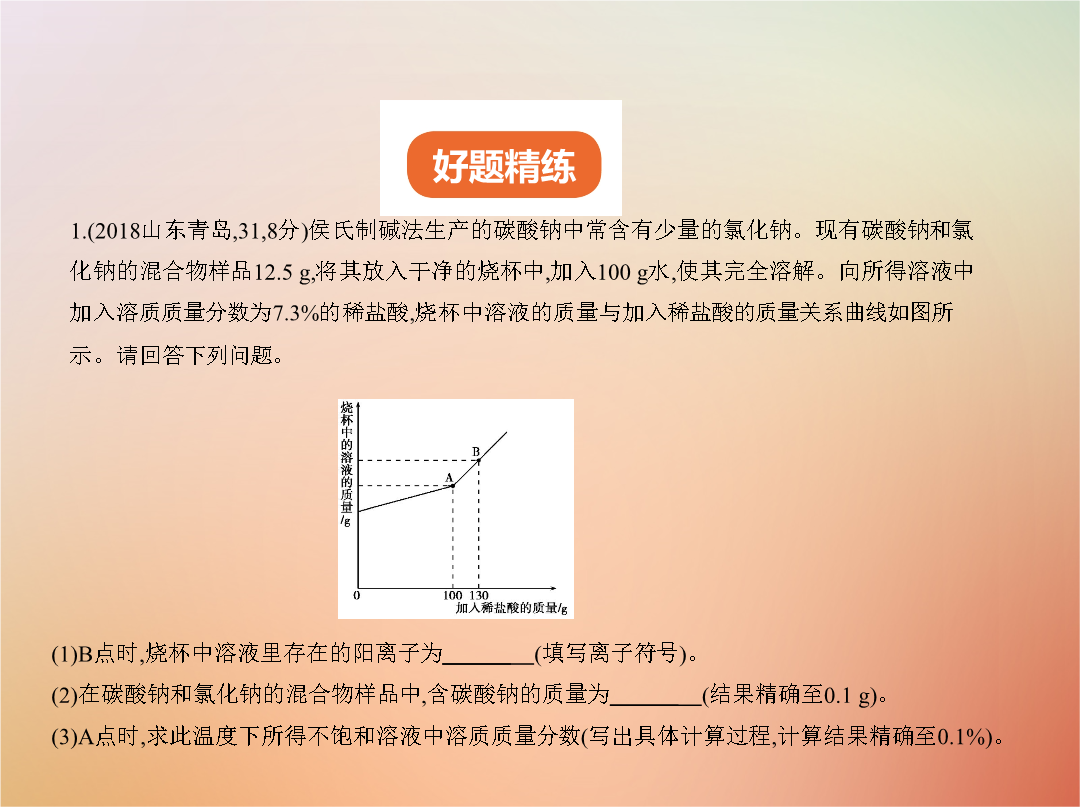
专题二十一化学计算题1.(2018山东青岛,31,8分)侯氏制碱法生产的碳酸钠中常含有少量的氯化钠。现有碳酸钠和氯化钠的混合物样品12.5g,将其放入干净的烧杯中,加入100g水,使其完全溶解。向所得溶液中加入溶质质量分数为7.3%的稀盐酸,烧杯中溶液的质量与加入稀盐酸的质量关系曲线如图所示。请回答下列问题。答案(1)H+、Na+(2)10.6g(3)解:设反应生成的NaCl的质量为x,生成的CO2质量为y。Na2CO3+2HCl 2NaCl+H2O+CO2↑1061174410.6gxy = x=11.7g = y=4.4g样品中NaCl质量为12.5g-10.6g=1.9gA点时溶液中NaCl(溶质)总质量为11.7g+1.9g=13.6gA点时溶液总质量为100g+12.5g-4.4g+100g=208.1gA点时溶液中溶质质量分数为 ×100%=6.5%答:A点时,此温度下所得不饱和溶液中溶质质量分数为6.5%。解析(1)由图像可知,当滴入稀盐酸至图中B点时,加入的稀盐酸是过量的,烧杯中溶液里的溶质为NaCl、HCl,故存在的阳离子是Na+、H+。(2)由图像可知,当滴入稀盐酸至图中A点时,即加入的稀盐酸的质量为100g时,溶液中的碳酸钠恰好与稀盐酸完全反应,然后根据化学方程式计算出碳酸钠的质量为10.6g。(3)碳酸钠与稀盐酸反应生成的氯化钠为11.7g,原混合物中的氯化钠质量为12.5g-10.6g=1.9g,由此可求出溶质的总质量,再求出反应后溶液的总质量,最后求出反应后溶液中溶质的质量分数。2.(2018山东潍坊A,27,8分)工业纯碱中常含有少量的氯化钠。某学习小组对其组成展开探究。现取24g纯碱样品,加入100g水使其完全溶解,再加入96g过量的氯化钙溶液,完全反应后,过滤、洗涤、干燥得沉淀20g。完成下列问题:(1)反应后溶液中含有的溶质是(写化学式)。(2)通过已知数据,能求出的量有(写字母序号)。A.反应后溶液的总质量B.参加反应的氯化钙的质量C.样品中碳酸钠的质量分数D.氯化钙溶液中溶质的质量分数(3)计算反应后溶液中氯化钠的质量分数。(写出计算过程,结果保留到0.1%)答案(8分)(1)NaCl、CaCl2(1分)(不全不得分)(2)ABC(2分)(选对2个得1分,选错1个不得分)(3)解:设参加反应的Na2CO3的质量为x,反应生成的NaCl的质量为y。Na2CO3+CaCl2 CaCO3↓+2NaCl (1分)106100117x20gy = x=21.2g (1分) = y=23.4g (1分)反应后溶液中NaCl的质量分数为: ×100%=13.1% (2分)答:略。解析(1)由于氯化钙溶液过量,所以反应后溶液中含有的溶质是CaCl2和NaCl。(2)根据质量守恒定律可得,反应后溶液的质量为24g+100g+96g-20g=200g,故A正确;根据反应的化学方程式,能计算出参加反应的氯化钙的质量和碳酸钠的质量,进而求出样品中碳酸钠的质量分数,故B、C正确;由于氯化钙溶液是过量的,所以不能根据消耗的氯化钙的质量计算氯化钙溶液中溶质的质量分数,故D错误。(3)根据题给信息可得,反应后溶液的质量为24g+100g+96g-20g=200g,根据碳酸钠和氯化钙反应的化学方程式可求出反应生成的氯化钠的质量,进而求出氯化钠的质量分数。3.(2018黑龙江齐齐哈尔,29,8分)向盛有28g氯化钡和氯化钠固体混合物的烧杯中加入273.3g水,固体完全溶解。再逐滴加入一定质量分数的硫酸钠溶液,反应过程中生成沉淀的质量与所加硫酸钠溶液的质量关系如图所示。(化学方程式为Na2SO4+BaCl2 2NaCl+BaSO4↓)请计算: (1)固体混合物中氯化钡的质量。(2)恰好完全反应时,所得溶液中溶质的质量分数。答案解:设混合物中氯化钡的质量为x,生成氯化钠的质量为y。Na2SO4+BaCl2 2NaCl+BaSO4↓208117233xy23.3g(1分) = (1分)x=20.8g(1分) = (1分)y=11.7g(1分)所得溶液中溶质质量分数为: ×100%=5%(2分)(列式对,得数错扣1分;列式错,扣2分)答:混合物中氯化钡的质量为20.8g,所得溶液中溶质的质量分数为5%。解、设、答及单位共计1分(以上几项有漏写或错误写法扣1分,但上述几项最多扣1分)解析(1)由题图可知,生成硫酸钡沉淀的质量为23.3g,利用化学方程式可直接计算出氯化钡的质量。(2)反应后所得溶液中的溶质是氯化钠,一部分是原固体混合物中的氯化钠:2

努力****星驰
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















