



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
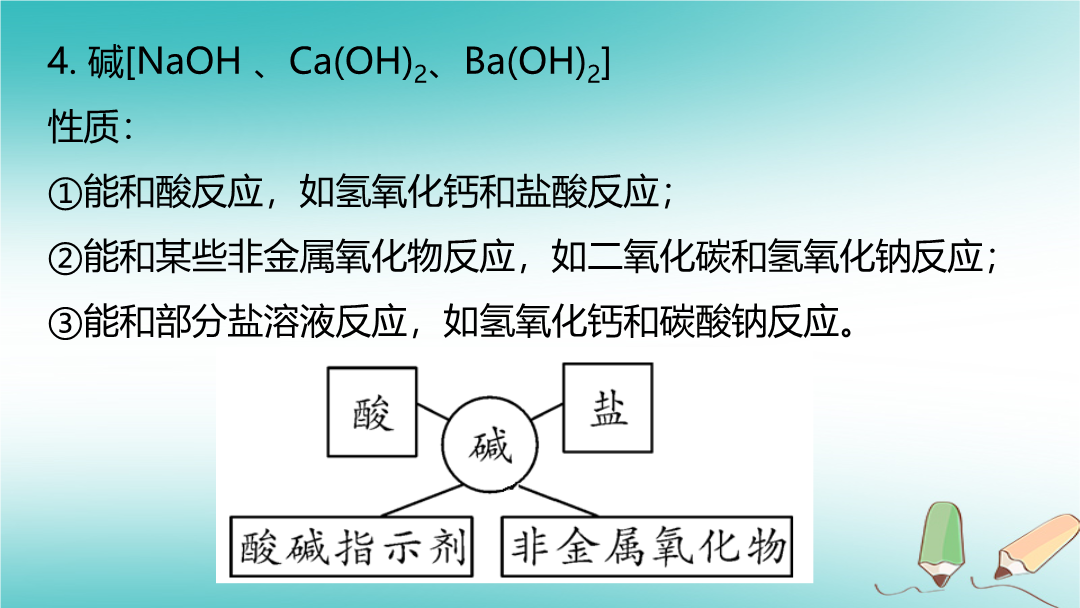
物质的推断(一)常考的物质及性质1.单质(Fe、Cu、Zn)性质:①和酸反应,如铁、锌和盐酸反应;②能和部分盐溶液反应,如锌和硫酸铜溶液反应。2.氧化物(CO2、CO、Fe2O3、CaO)CO2:①能和氢氧化钙反应生成碳酸钙沉淀;②高温煅烧石灰石能生成二氧化碳;③稀盐酸和碳酸盐反应能生成二氧化碳。CO:能还原金属氧化物生成二氧化碳和金属单质。Fe2O3、CuO:①能和酸反应生成盐和水;②能与氢气、碳、一氧化碳等还原性物质反应生成金属单质。CaO:①能和水反应生成氢氧化钙;②高温煅烧石灰石能生成氧化钙。3.酸(HCl、H2SO4)性质:①能和活泼金属反应,如锌和硫酸反应;②能和金属氧化物反应,如氧化铜和盐酸反应;③能和碱反应,如氢氧化钠和盐酸反应;④能和部分盐反应,如碳酸钠和硫酸反应。4.碱[NaOH、Ca(OH)2、Ba(OH)2]性质:①能和酸反应,如氢氧化钙和盐酸反应;②能和某些非金属氧化物反应,如二氧化碳和氢氧化钠反应;③能和部分盐溶液反应,如氢氧化钙和碳酸钠反应。5.盐常见的盐:①碳酸盐:Na2CO3、CaCO3、BaCO3等;②氯化盐:BaCl2、CuCl2、MgCl2等;③硫酸盐:CuSO4、Na2SO4、BaSO4等;④硝酸盐:Ba(NO3)2、AgNO3等。性质:①能和金属反应(必须是相对活泼的金属置换不活泼的,K、Ca、Na除外),如硫酸铜和铁反应;②能和酸反应,如碳酸钙和盐酸反应;③能和碱反应,如硫酸铜和氢氧化钠反应;④能和盐反应,如氯化钠和硝酸银。(二)常考物质的三角关系二、物质的状态和颜色颜色2.溶液的颜色3.初中常见的7种沉淀(1)蓝色沉淀:Cu(OH)2(碱)。(2)红褐色沉淀:Fe(OH)3(碱)。(3)白色沉淀:盐:BaSO4、AgCl、CaCO3、BaCO3;碱:Mg(OH)2。①不溶于水也不溶于稀硝酸的白色沉淀(盐):BaSO4、AgCl。②溶于酸并有气体放出的白色沉淀(盐):CaCO3、BaCO3。③溶于酸但没有气体放出的白色沉淀(碱):Mg(OH)2。三、物质的俗名、主要成分、化学式俗名(名称)1.造成温室效应的主要气体是________。2.可用于冶炼金属的是碳、氢气、一氧化碳。3.最清洁的燃料是_____。4.常用于灭火的物质是水、CO2。5.炉具清洁剂中含有________,用于清洗油污。6.胃液的主要成分,能帮助人体消化的是_____。7.可作干燥剂的是浓硫酸、氢氧化钠固体、碱石灰。8.能治疗胃酸过多的是碳酸氢钠、氢氧化铝、氢氧化镁。9.可用于建筑材料的是碳酸钙、氢氧化钙。10.能改良酸性土壤的是氢氧化钙。11.可作补钙剂的是碳酸钙。12.常用作调味品、配制生理盐水的是氯化钠。13.发酵粉的主要成分是碳酸氢钠,并可用来焙制糕点。1.物质之最(1)人类使用最广、年产量最高、合金中使用最多的金属单质______。(2)生物体内含量最多的物质、人类赖以生存的无色液体、最常用的溶剂________。(3)最理想的燃料________。(4)最简单的有机物__________。(5)相对分子质量最小的单质________。(6)相对分子质量最小的氧化物________。(7)相同条件下,密度最小的气体________。(8)易与血红蛋白结合,造成人体中毒的气体____________。(9)天然存在最硬的物质___________。2.元素之最(1)地壳中含量最多的元素____,最多的金属元素_____。(2)相对原子质量最小的元素____。1.气体:CO2和CO。2.液体:H2O和H2O2。3.固体:Fe2O3和Fe3O4。4.溶液中溶质:铁盐与亚铁盐,如FeCl3和FeCl2、Fe2(SO4)3和FeSO4。氧化物补充:1.能使澄清石灰水变浑浊的无色无味的气体:CO2。2.生成蓝色沉淀:可溶性碱与可溶性铜盐反应。(1)D的化学式__________。(2)E→C反应的化学方程式________________________________________。(1)C的化学式____________。(2)B、C间反应的化学方程式为______________________________。【解析】(1)由反应关系图可知,C物质可与四种物质反应,在所提供的五种物质中,只有H2SO4可以与NaOH、Na2CO3、Ca(OH)2、BaCl2四种物质反应,故C为H2SO4,F不能与H2SO4反应,故F为CO2。则A、B、D、E为NaOH、Na2CO3、Ca(OH)2、BaCl2四种物质之一。D和E都能与CO2反应,故D和E为NaOH、Ca(OH)

俊英****22
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















