



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
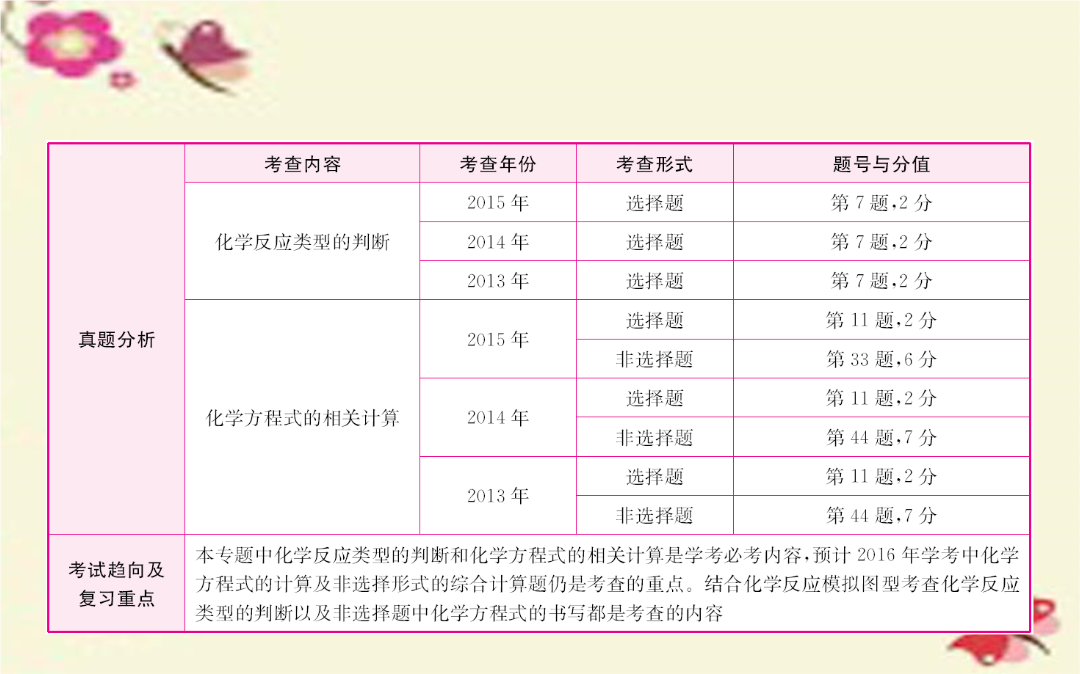
一、化学方程式1.定义:用_________表示化学反应的式子。2.书写原则:①必须以____________为依据;②遵循_________________。二、初中化学常见的反应类型1.化合反应:由___________以上物质生成__________物质的化学反应。2.分解反应:由_______物质生成____________以上其他物质的化学反应。3.置换反应:一种______和一种_________生成另一种_____和另一种_________的化学反应。4.复分解反应:两种________互相______成分,生成另外两种_______的化学反应。5.氧化反应:物质跟______发生的化学反应属于氧化反应。6.还原反应:_________的化学反应。考点1化学反应类型的判断例1(2015·青岛)常用化肥碳酸氢铵不稳定,受热易发生反应:NH4HCO3NH3↑+CO2↑+H2O,该反应属于()A.置换反应B.复分解反应C.分解反应D.化合反应解析:由题目中所给化学方程式可知,碳酸氢铵不稳定受热分解生成氨气、二氧化碳和水。该反应是由一种物质生成两种或两种以上的物质,属于四种基本反应类型中的分解反应。故选C。答案:C考点2化学方程式的相关计算有关化学方程式的计算的基本形式:根据化学方程式,由一种反应物(或生成物)的质量求生成物(或反应物)的质量的计算;含一定量杂质(杂质不参加反应)的反应物或生成物的计算。根据化学方程式计算的关键是正确书写化学方程式。无论已知条件如何,只要是物质之间通过化学反应发生量的变化,都要先分析在给定的条件下,物质之间能否发生反应。例2(2015·济南)烧杯中有一定质量的MgO和MgCO3的混合物,向其中加入150g稀盐酸,恰好完全反应,一定温度下,得到156g不饱和溶液。下列数据中,与该溶液的溶质质量分数最接近的是()A.16.6%B.6.1%C.12.2%D.9.1%解析:根据MgO和MgCO3与盐酸反应的特点分析,MgO和MgCO3分别与盐酸反应溶液的增重相同,当增重相同时,所得溶液的质量分数应相同。由方程式:MgO+2HCl====MgCl2+H2O溶液增重409540MgCO3+2HCl====MgCl2+H2O+CO2↑溶液增重84954440可知,当溶液的增重相同时,生成的氯化镁的质量相同,所得溶液的质量分数是相等的。解:设生成的氯化镁的质量为x。MgO+2HCl====MgCl2+H2O溶液增重409540x156g-150g所得溶液的溶质质量分数为:。由此可知,所得溶液的溶质质量分数最接近的是D。答案:D例3(2013·济南)在工业上用纯碱和石灰石为原料制备烧碱,主要流程如图所示:(1)在①~④四个过程中,发生分解反应的是______(填序号)。(2)检验烧碱溶液中含有Na2CO3的具体方法是__________________________________________________。(3)在室温下,将53g溶质质量分数为10%的Na2CO3溶液与3000g澄清石灰水充分混合,恰好完全反应。则这时所得NaOH溶液的质量是多少?(计算结果精确至0.1g)解析:本题以工业上由纯碱和石灰石为原料制备烧碱的主要流程为主线,考查了化学基本反应类型、的检验、溶液和化学方程式的有关计算等知识点,取材别致、立意独特、难度适中。答案:(1)①(2)取少量该烧碱溶液于一试管中,再加入足量的稀盐酸或稀硫酸。若产生气泡,则有Na2CO3;若无明显现象,则没有Na2CO3(3)Na2CO3溶液中溶质的质量为:53g×10%=5.3g。解:设生成CaCO3的质量为x。Ca(OH)2+Na2CO3====CaCO3↓+2NaOH1061005.3gx所得NaOH溶液的质量为:53g+3000g-5g=3048.0g。答:所得NaOH溶液的质量为3048.0g。例4在一烧杯中盛有一定质量的金属镁,向其中加入足量的稀硫酸,至恰好完全反应,在一定温度下得到30gMgSO4的不饱和溶液。向所得溶液中逐滴滴入溶质质量分数为10%的NaOH溶液,溶液的总质量与滴入NaOH溶液的质量的关系曲线如图所示。请根据题意回答下列问题:(1)写出在整个实验过程中观察到的一项实验现象:_____________________________________________。(2)当滴入过量NaOH溶液至图中B点时,烧杯中溶液里含有的溶质为________、________(写化学式)。(3)当滴入10%的NaOH溶液40g时(即图中A点),恰好完全反应。试通过计算,求此时烧杯中所得不饱和溶液的质量(计算结果精确到

是你****韵呀
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















