

如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
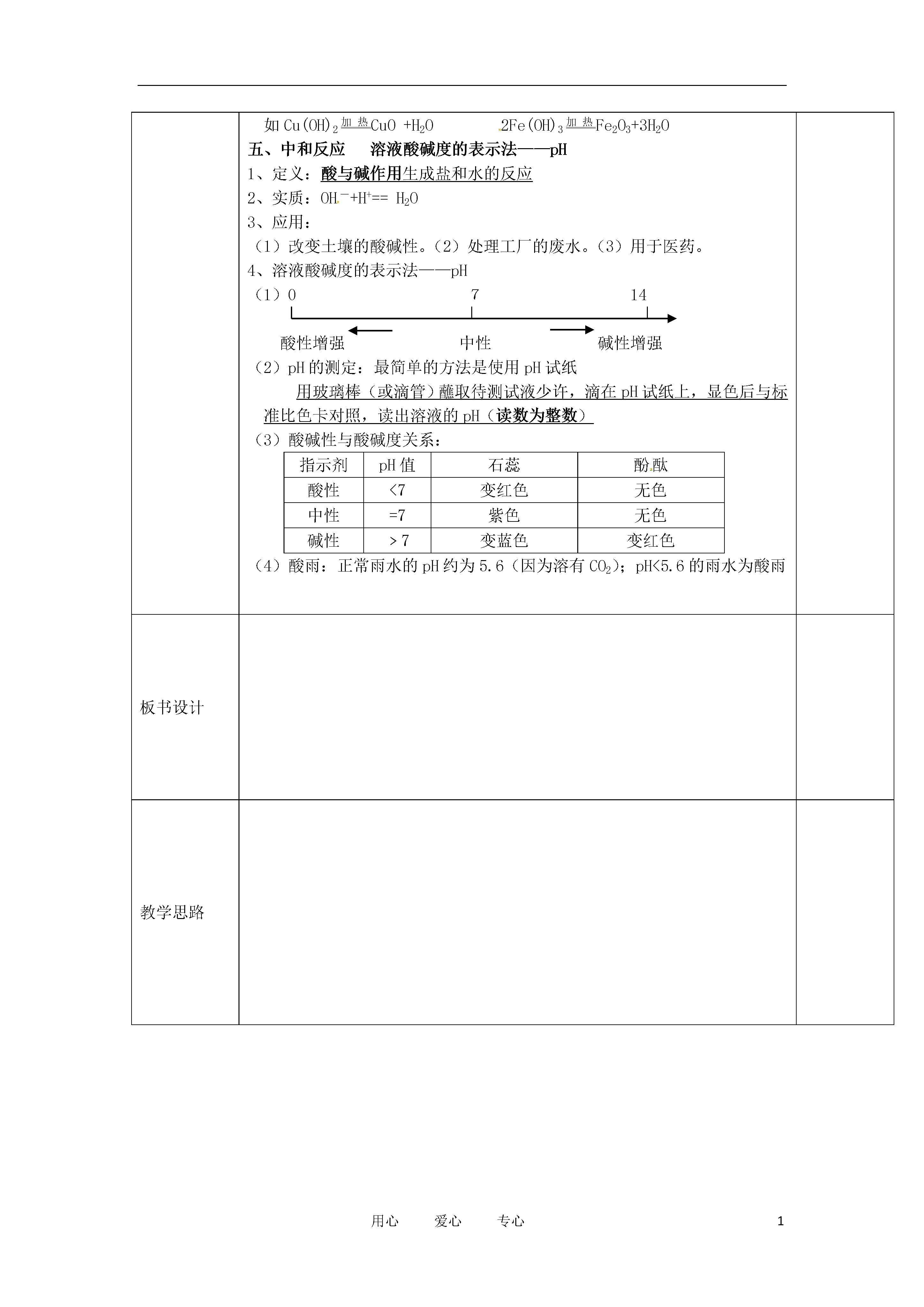
1用心爱心专心课题§常见的酸和碱复习设计教师教学目标知识与技能1.了解生活和实验中常见的酸和碱,掌握几种常见酸和碱的性质及用途,理解酸和碱各有其相似性质的原因。2.在掌握酸和碱性质及用途的基础上,进一步了解酸和碱之间发生的中和反应以及中和反应在实际中的应用。3.溶液的酸碱度的表示方法——pH。过程与方法4.本单元是初中化学学习中比较重要的一单元,在学习探究中应培养自己归纳、总结的能力。在学习酸碱的知识过程中,应了解人类认识事物的过程,一般遵循先认识个别事物,然后逐步地扩大到认识一类事物的规律。5.通过学习典型物质——盐酸、硫酸、氢氧化钠、氢氧化钙等物质的性质,找出酸、碱与其他物质发生反应的规律和特点,掌握判断化学反应能否进行的方法,并学会分析、猜想哪些反应可以发生,逐步形成良好的学习习惯和方法,培养严谨的思维方法。情感态度与价值观6.了解酸和碱发生化学反应的规律及伴随的现象,利用这些规律解决生产生活及环境保护中遇到的实际问题,如如何处理化工厂排放的污水,可以根据所学化学知识提出合理化建议;农业生产中,强酸性土壤不适合农作物的生长,可以施入适量的熟石灰中和土壤,以及医药上酸和碱中和反应的应用等。培养自己学习化学的兴趣,增强为祖国现代化发展努力学习的动力。教材分析重点酸和碱的用途是中考考察的重点。主要考察盐酸、硫酸、氢氧化钠、氢氧化钙的化学性质在生产、生活以及人类生命活动中的广泛应用难点中和反应和浓硫酸的稀释方法以及用指示剂鉴别酸碱性教学方法教具课时2课时教学补充教学过程简记一、酸、碱、盐的组成酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)碱是由金属元素和氢氧根组成的化合物如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)盐是由金属元素元素(或铵根)和酸根组成的化合物如:氯化钠、碳酸钠酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)二、酸1、浓盐酸、浓硫酸的物理性质、特性、用途浓盐酸浓硫酸颜色、状态“纯净”:无色液体工业用盐酸:黄色(含Fe3+)无色粘稠、油状液体气味有刺激性气味无特性挥发性(敞口置于空气中,瓶口有白雾)吸水性脱水性强氧化性腐蚀性用途①金属除锈②制造药物③人体中含有少量盐酸,助消化①金属除锈②浓硫酸作干燥剂③生产化肥、精炼石油2、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色(2)金属+酸→盐+氢气(3)金属氧化物+酸→盐+水(4)碱+酸→盐+水(5)盐+酸→另一种盐+另一种酸(产物符合复分解条件)3、三种离子的检验试剂Cl-AgNO3及HNO3SO42-①Ba(NO3)2及HNO3②HCl及BaCl2CO32-HCl及石灰水三、碱1、氢氧化钠、氢氧化钙的物理性质、用途氢氧化钠氢氧化钙颜色状态白色固体,极易溶于水(溶解放热)白色粉末,微溶于水俗名烧碱、火碱、苛性钠(具有强腐蚀性)熟石灰、消石灰制法Ca(OH)2+Na2CO3==CaCO3↓+2NaOHCaO+H2O==Ca(OH)2用途①氢氧化钠固体作干燥剂②化工原料:制肥皂、造纸③去除油污:炉具清洁剂中含氢氧化钠①工业:制漂白粉②农业:改良酸性土壤、配波尔多液③建筑:2、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH-)(1)碱溶液与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色(2)非金属氧化物+碱→盐+水(3)酸+碱→盐+水(4)盐+碱→另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)四、非金属氧化物与金属氧化物非金属氧化物金属氧化物化学性质(1)大多数可与水反应生成酸CO2+H2O==H2CO3SO2+H2O==H2SO3SO3+H2O==H2SO4(1)少数可与水反应生成碱Na2O+H2O==2NaOHK2O+H2O==2KOH可溶BaO+H2O==Ba(OH)2性碱CaO+H2O==Ca(OH)2(2)酸性氧化物+碱→盐+水CO2+Ca(OH)2==CaCO3↓+H2O(不是复分解反应)(2)碱性氧化物+酸→盐+水Fe2O3+6HCl==2FeCl3+3H2O注:难溶性碱受热易分解(不属于碱的通性)如Cu(OH)2加热CuO+H2O2Fe(OH)3加热Fe2O3+3H2O五、中和反应溶液酸碱度的表示法——pH1、定义:酸与碱作用生成盐和水的反应2、实质:OH-+H+==H2O3、应用:(1)改变土壤的酸碱性。(2)处理工厂的废水。(3)用于医药。4、溶液酸碱度的表示法——pH(1)0714酸性增强中性碱性增强

一只****呀9
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















