


如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
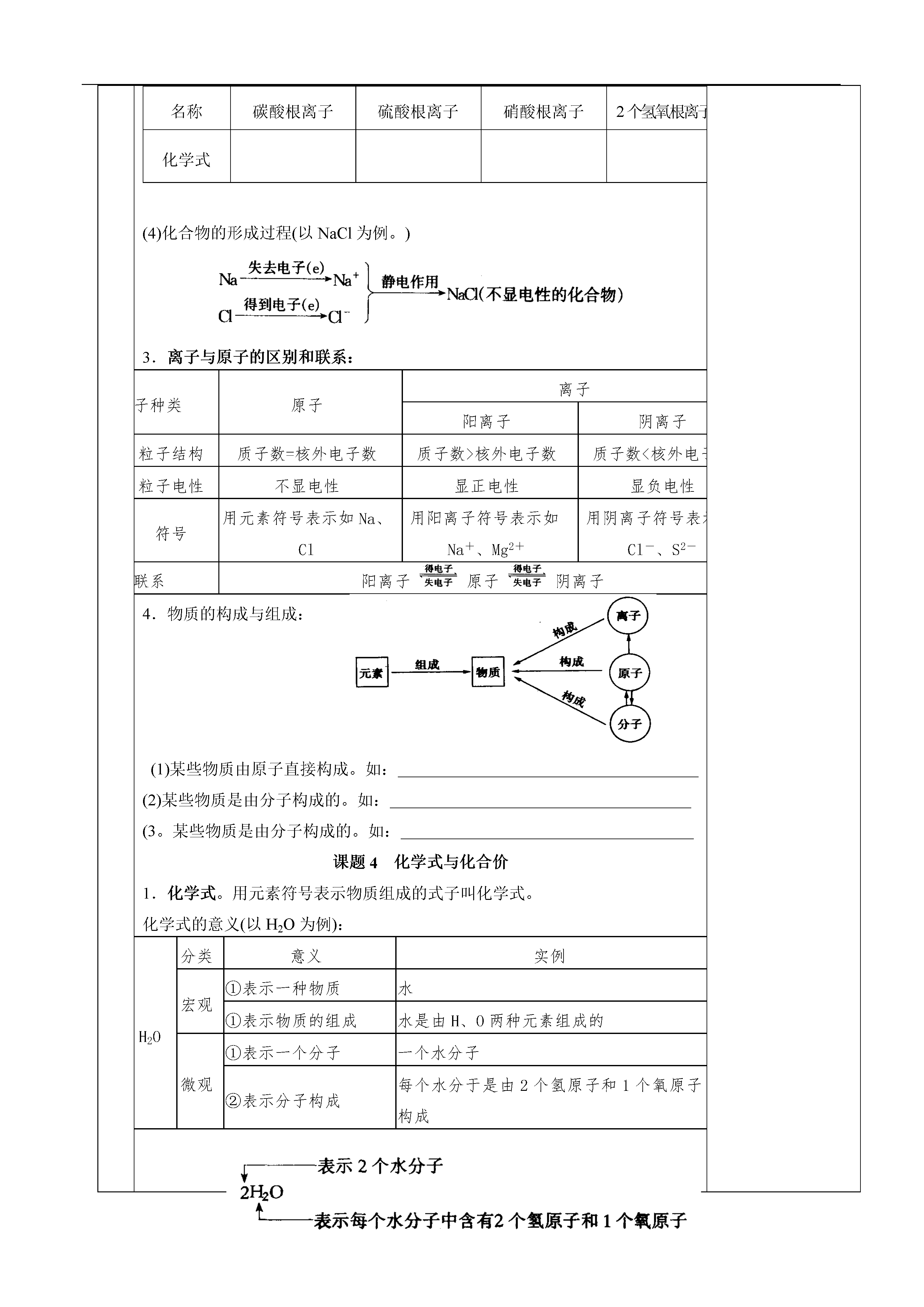
课题第四讲物质构成的奥秘主备人备课时间周星期第1课时备课组长签名考研组长签名教学内容第四讲物质构成的奥秘个性化备课教学目标知识技能归纳整理本讲内容过程与方法情感态度价值观教学重点本讲基础知识教学难点归纳整理、识记理解教学过程第四单元物质构成的奥秘课题1原子的构成1.原子的组成质子:每一个带1个单位正电荷。原子中子:不带电:每一个带1个单位负电荷⑴原子核所带电量数称为核电荷数,由于原子核所带电量和核外电子的电量相等,但电性相反,因此原子电性。核电荷数==核外=⑵原子核内的质子数不一定等于中子数,普通的氢原子的原子核内无中子。⑶原子的种类是由核()决定的。⑷原子核只占原子体积的很小一部分,原子内相对有一个很大的空间,电子在这个空间里作高速运动。2.相对原子质量一个质子的质量≈一个中子的质量≈一个电子的质量×1836相对原子质量≈+。课题2元素1.元素。元素是的总称。(1)地壳中含量前四位元素(质量分数):(2)生物细胞中含量在前四位元素:2.元素符号。意义:①表示一种元素;②表示这种元素的一个原子。例:N表示的意义有:和。如果在元素符号前面添加系数,就只表示该元素的原子个数,不能表示该元素。如H既表示氢元素又能表示一个氧原子,而2H只能表示;3Fe表示;若要表示5个镁原子可记为:,7个氯原子可记为:。元素与原子的比较元素原子区别是宏观概念,只表示种类,不表示个数是微观概念,既表示种类,又表示个数适用范围表示物质的宏观组成,如水是由氢元素和氧元素组成的表示物质的微观构成。如1个水分子是由2个氢原子和1个氧原子构成联系元素是核电荷数相同的一类原子的总称原子是元素的最小粒子(2)书写:①由一个字母表示的元素符号要大写;①由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写。例如:钙,钠,钴镁,铝等。(3)元素中文名称的特点:金属元素除“汞”以外都是“金”旁,例如:非金属元素按单质在通常情况下的存在状态分别加“石”、“气”、“水”等偏旁,因此我们可以从它们的偏旁判断属于哪类元素。3.元素周期表。元素周期表的结构:①每—格:周期表每一格占据一种元素.②周期:周期表每一横行叫做—个。共有个横行,有个周期。③族:每一个纵行叫做一个族,第(8、9、10三个纵行共同组成一个族外),共有16个族。课题3离子1.核外电子的排布。(1)核外电子的分层排布:元素的原子核外的电子层最少有1层,最多有7层;第一层不超过个电子,第二层不超过个电子,最外层不超过个电子(只有1个电子层的最外层不超过2个电子)。(2)原子结构简图各部分的意义:(3)相对稳定结构:最外层具有电子(只有一个电子层的元素具有2个电子)的结构属于相对稳定结构。(4)元素性质与元素最外层电子数的关系:元素分类最外层电子数得失电子倾向化学性质稀有气体元素8个(He为2个)不易得失、相对稳定稳定金属元素一般4个易最外层电子不稳定非金属元素一般4个易电子不稳定(5)元素的性质,特别是元素的化学性质,是由决定的。2.离子的形成。(1)离子:因得失电子而带电荷的原子或原子团叫离子。如Na+、Cl-—、OH-、SO42--等失去一个电子(2)离子的分类。阳离子:带正电的原子如NaNa+得到一个电子离子阴离子:带负电的原子如ClCl-(3)离子符号及其意义(数字“2”的意义)。填空:写出下列各符号名称氢离子钡离子铝离子2个亚铁离子5个钙离子化学式名称碳酸根离子硫酸根离子硝酸根离子2个氢氧根离子3个铵根离子化学式(4)化合物的形成过程(以NaCl为例。)3.离子与原子的区别和联系:粒子种类原子离子阳离子阴离子区别粒子结构质子数=核外电子数质子数>核外电子数质子数<核外电子数粒子电性不显电性显正电性显负电性符号用元素符号表示如Na、Cl用阳离子符号表示如Na+、Mg2+用阴离子符号表示如Cl-、S2-联系阳离子原子阴离子4.物质的构成与组成:(1)某些物质由原子直接构成。如:(2)某些物质是由分子构成的。如:(3。某些物质是由分子构成的。如:课题4化学式与化合价1.化学式。用元素符号表示物质组成的式子叫化学式。化学式的意义(以H2O为例):H2O分类意义实例宏观①表示一种物质水①表示物质的组成水是由H、O两种元素组成的微观①表示一个分子一个水分子②表示分子构成每个水分于是由2个氢原子和1个氧原子构成写出下列符号的意义:3Fe,5Al2O3,2H2.写出下列化学语的符号:4个钠离子:,2个氯气分子:,氮气,4个硫酸分子:,氧元素:,3个碳酸分子:2.化

一只****呀盟
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















