



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
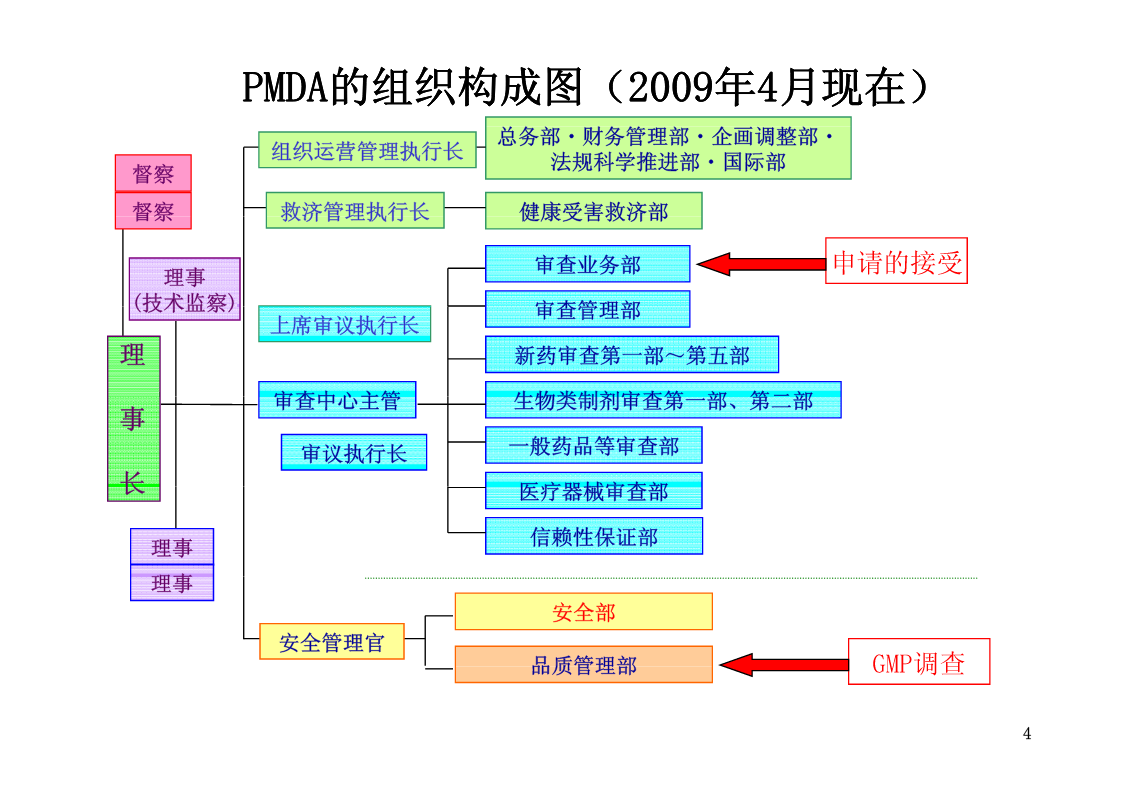
关于PMDA实施的GMP 符合性调查 独立行政法人医药品医疗器械综合机构 品质管理部部长 新见裕一 2009年6月23日CPhIChina2009 1 关于演讲内容 1.品质管理部以及GMP相关业务的概要 2.GMP符合性调查业务 3.品质管理部提供的GMP调查实际业绩 4.国外实地调查实施上的注意点 5.关于PMDA官方网站的介绍 2 1.品质管理部以及GMP相关业务的概要 3 PMDAPMDA的组织构成图的组织构成图((20092009年年44月现在月现在)) 总务部・财务管理部・企整部企画调整部・ 组织运营管理执行长法规科学推进部・国际部 督察 督察救济管理执行长健康受害救济部 审查业务部申请的接受 理事 (技术监察)审查管理部 理上席审议执行长 新药审查第一部~第五部 事审查中心主管生物类制剂审查第一部、第二部 一般药品等审查部 长审议执行长 医疗器械审查部 信赖性保证部 理事 理事 安全部 安全管理官 品质管理部GMP调查 4 PMDA的GMP/QMS调查体制的强化 ・GMP/QMS调查担当人员的持续增加 通过公开招聘采用职员・临时职员。 (接受出身于民间企业的人员。活用在家工作形 式。) 2004年4月・・・6人 2005年4月・・・18人 2006年4月・・・26人 2007年4月・・・30人 2008年4月・・・37人 2009年4月现在・・・40人 5 GMP相关申请窗口 •GMP符合性调查申请 →GMP调查主体(PMDA、都道府县) •(日本国内的)制造业许可之相关(构造设备) 调查申请 →都道府县(大臣许可相关申请经由都道府县再到厚 生局、PMDA):和许可申请同时 •国外制造厂商认定之相关(构造设备)调查申请 →PMDA:和认定申请同时 *综合机构的申请窗口请至「审查业务部」 6 PMDA管内的GMP相关调查业务(医药品) •GMP符合性调查业务(认可必要条件调查) 药事法第14条第6项:对GMP标准的符合性调查 •对出口用医药品的GMP符合性调查业务 药事法第80条第1项:对GMP标准的符合性调查 •构造设备符合性调查业务(许可必要条件调查) 药事法第13条第5项:对药房等构造设备规则的符合性调查 •国外制造场所认定之相关调查业务(认定必要条 件调查) 药事法第13条第3款第3项:对药房等构造设备规则的符合性调查 •其他调查业务(现场检查等) 药事法第69条第2款第1项:对制造厂商的现场检查等 药事法第75条第2款第3项:对国外特例认可取得者的现场检查等 药事法第75条第4款第3项:对国外制造厂商的现场检查等等 7 2.GMP符合性调查业务 基于新药事法的认可必要条件调查、 伴随出口申报的符合性调查 8 GMP的定位 (旧):~2005年3月(新):2005年4月~ *制造厂商和制造销售厂商的分离 制造(进口销售)厂商制造销售厂商 许可(每个种类) 许可(每个品目)制造厂商 必要条件 必要条件 许可(每分・GQP(品质管理基准) ・构造设备(硬件)类)必要条・GVP(上市后安全管理基准) ・GMP(软件)件(为国外制・申请者不符合取消资格条件 造场所的认定必认可(每个品目) ・申请者不符合取消资格条件要条件) 必要条件 ・构造设备 认可(每个品目)・品质、有效性、安全性 必要条件(基本硬 件)・申请者取得制造销售业 许可 ・品质、有效性、安全性・申请者不符 ・制造场所符合GMP(软 合取消资格件+硬件) 条件 *认可是为了取得许可的前提条件遵守GMP 9 PMDA实施的GMP符合性调查(医药品) ○下列品目的制造之相关设施 –新医药品(2007年4月~都道府县→综合机构) (*在再审查结果出来之前的新医药品) –生物制剂 –检定医药品 –放射性医药品 –应用基因重组技术医药品 –应用细胞培养技术医药品 –特定生物由来产品 –细胞组织医药品 ○国外的GMP对象设施(2007年4月~新的) 10 GMP/QMS调查和调查权所有者 国内制造场国外制造场 所所 医新医药品、生物制剂、PMDAPMDA 放射性医药品等 药 其他医药品都道府县PMDA 品 医新医疗器械、细胞组织PMDAPMDA 医疗器械、级别Ⅳ 疗 级别Ⅲ、级别Ⅱ(无认都道府县PMDA 器证基准的产品) 械级别Ⅱ(具有认证基登记认证登记认证 准的产品)机关机关 11 PMDA实施GMP实地调查的流程 申请者(制造销售厂商) GMP符合性调查申请 PMDA (申请受理)审查业务部 日程调整 制造销售厂商 品质管理部/调查通知 GMP调查制造厂 商等 (GMP调查担当)指责事项制造销售 改进报告等厂商 符合性调查结果报告书(复印件)+ GMP符合性调查符合性调查

一只****写意
 实名认证
实名认证
 内容提供者
内容提供者
最近下载
一种胃肠道超声检查助显剂及其制备方法.pdf
201651206021+莫武林+浅析在互联网时代下酒店的营销策略——以湛江民大喜来登酒店为例.doc
201651206021+莫武林+浅析在互联网时代下酒店的营销策略——以湛江民大喜来登酒店为例.doc
用于空间热电转换的耐高温涡轮发电机转子及其装配方法.pdf
用于空间热电转换的耐高温涡轮发电机转子及其装配方法.pdf
用于空间热电转换的耐高温涡轮发电机转子及其装配方法.pdf
用于空间热电转换的耐高温涡轮发电机转子及其装配方法.pdf
用于空间热电转换的耐高温涡轮发电机转子及其装配方法.pdf
用于空间热电转换的耐高温涡轮发电机转子及其装配方法.pdf
论《离骚》诠释史中的“香草”意蕴.docx


















