



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
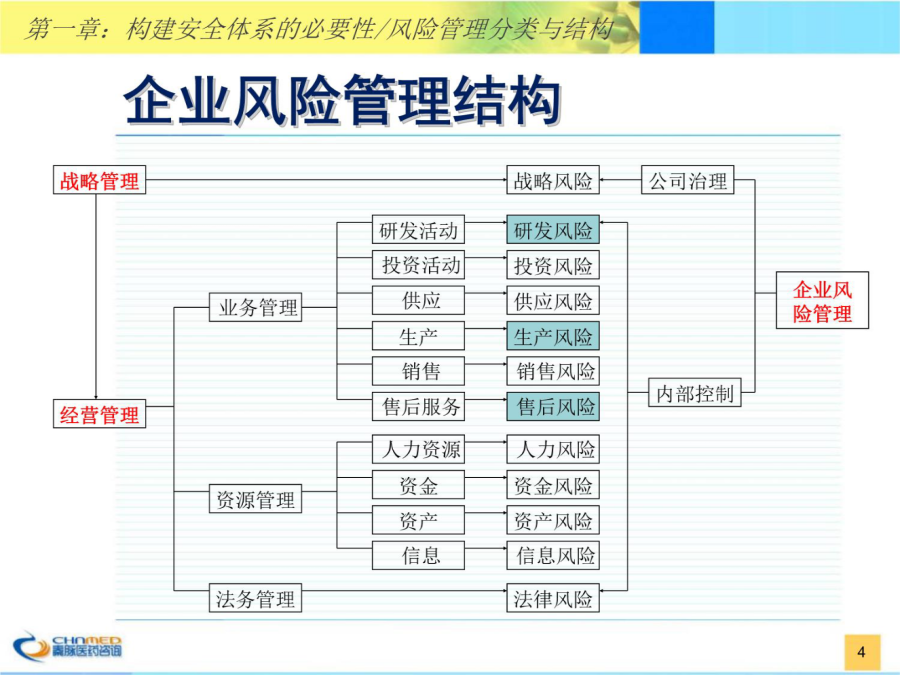
构建企业药品安全体系任重而道远目录 构建药品安全体系的必要性与紧迫性 控制药品安全方面常见问题与相关隐患 构建企业药品安全体系的相关建议 实施方案与应急措施构建企业药品安全体系的必要性与紧迫性 企业风险管理分类与结构 构建安全体系的必要性 药品安全背景知识 药品安全事件案例 国家相关政策法规战略风险管理业务风险分析资源风险分析法务风险分析构建企业药品安全体系的必要性预期目标与紧迫性药品安全背景知识(1)药品安全背景知识(2)药品安全背景知识(3)药品安全背景知识(4)根据美国药典一份对注射剂无菌指标的相关测试报告可以看到: 注射剂药品的无菌不合格对于患者是致命的,任何一支不合格注射剂都可使患者产生热原反应,如抢救不及时很快就能导致患者死亡 现行国家药典规定检验20支合格就可放行!药品质量差异是否是客观存在?典型案例1—欣弗事件典型案例1—欣弗事件典型案例1—欣弗事件典型案例2—沙利度胺典型案例2—沙利度胺典型案例2—沙利度胺国家相关法规与管理规定1国家相关法规与管理规定2国家相关法规与管理规定3国家相关法规与管理规定4新版GMP的主要改变1结构框架 采用章节条目编排(原来只是章、条) 基本要求(通则)内容从88条增至310条,文字从0.76万增加到约3.5万 附录新增了血液制品附录,重中之重地修订了无菌药品附录 硬件 全面采用欧盟和WHO的洁净度标准(A、B、C、D级) 对无菌制剂采用更加严格的标准 软件 对建立质量保证体系和文件记录的编制、填写提出了细致详尽的要求 引入或明确了质量风险管理、设计确认、变更控制、偏差处理、CAPA、OOS、供应商审计和批准、产品质量回顾分析、持续稳定性考察等概念湿件 明确了关键人员概念,对其资质和能力提出了更高要求 实行质量受权人制度 质量管理 企业应建立并实施质量管理体系要求的质量目标 企业高层管理人员应确保实现既定的质量目标 各部门不同层次人员及供应商、经销商共同参与,承担各自的责任 将药品注册中有关药品安全、有效和质量可控的所有要求,系统地贯彻到药品生产、控制及产品放行、发运的全过程中 确保所生产的药品适用于预定用途、符合药品标准和规定的要求 对质量保证系统建设提出了明确要求 药品的设计和研发 生产管理和质量控制活动 明确管理职责 保证物料准确无误 确保中间控制 确保验证实施 严格按书面规程生产、检查、检验、复核 质量授权人批准放行; 保证贮存、发运等过程的药品质量 定期自检评估应考虑规范的要求 赋予质量管理新的内涵和责任 建立质量风险管理体系 对药品整个生命周期进行质量风险的识别评估、控制、沟通、回顾文件管理体系 强化文件管理,尤其对技术标准文件的制定提出了详细要求 质量标准(物料、中间产品和待包装产品、成品) 工艺规程 批生产记录 批包装记录 操作规程和记录 批记录的复制、发放、更改、重新誊写都提出具体要求,增加了虚假记录、违规/不规范记录的操作难度 建立批档案 文件保存 确认和验证、稳定性考察的记录报告等重要文件长期保存人员要求 突出了人员作用,强调了关键人员,提高了要求 企业负责人 质量受权人 生产管理负责人 质量管理负责人 人员要求的主要改变 学历:大专→本科,专业提出了具体的学科要求 管理经验:从事管理的年限(3年、5年、5年) 质量受权人:从事过生产和质量管理的要求 一定数量→足够数量 对关键人员规定了相应职责厂房洁净度要求 洁净级别采用了欧盟的标准 A:动态百级,一般需采用无菌隔离技术 B:相当于百级,并有动态标准 C:相当于万级,并有动态标准 D:相当于十万级 非最终灭菌的无菌产品处于未完全密封状态的操作和转运需在B级背景下的A级区生产 无菌原料药粉碎、过筛、混合、包装需在B级背景下A级区生产 轧盖须在C级背景下的A级送风环境生产(达到静态A级),因产生脱屑,应单独隔离 最终灭菌的高污染风险的无菌产品的灌装/灌封工序需在C级背景下的A级区生产; 有无菌要求的中药制剂其最后精制工序应至少在D级洁净区内完成,之后的工序应在C级背景下; 洁净区与非洁净区之间、不同等级洁净区之间的压差不低于10Pa,相同洁净等级不同功能的操作间之间应保持适当的压差梯度 常见问题与相关隐患 组织保障上的缺陷 药品研发体系中存在的问题 药品生产质量保证体系(GMP)中存在的问题 药物警戒体系中存在的问题 相关隐患组织管理结构上的重大缺陷药品研发体系中存在的问题1药品研发体系中存在的问题2药品研发体系中存在的问题3生产质量保证体系中存在的问题1缺少产品质量风险管理 未针对产品的关键质量特性建立质量风险管理 QA监控体系未按照产品的质量风险管理构建 日常监控、偏差调查、自检等监控活动中未进行动态的质量管理 产品工艺合理不合法现象 部分产品存在与注册批准不符的问题,存在违规生

王子****青蛙
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















