

如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
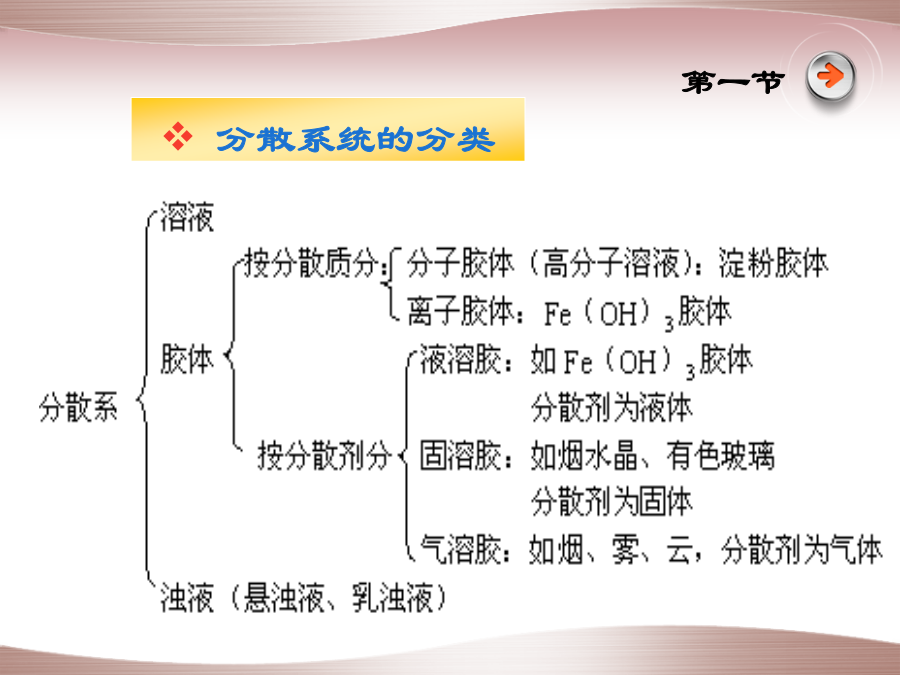
医学化学第二讲胶体溶液第四章胶体溶液一种(或多种)物质分散于另一种物质形成的系统第一节第一节第二节表面现象液体内部分子所受各方向的引力平衡,合力为零。因此可以自由移动而不需做功 液体表面分子受内部分子的吸引力大,受气体分子的吸收力小,合力方向指向液体内部,将其拉向液体内部表面能:表面分子比内部分子多余的能量。表面吸附:处于物质表面的分子可以吸附周围介质中小的分子或离子以降低表面能 胶体的微粒具有很大的表面积,因此具有较强的吸附能力。表面吸附 应用乳化:一种液体分散在另一种互不相溶的液体中,形成高度分散体系的过程 乳状液:通过乳化得到的分散系。自身不稳定,静置后自动分层 乳化剂:通过加入表面活性剂作为乳化剂,降低界面张力和能量,并防止分散相粒子间的相互聚集,使乳状液变稳定。油脂在体内的消化、吸收和转运 油性药物制成乳状液易于服用和吸收——鱼肝油悬浊液第三节溶胶溶胶的许多性质都与其高分散度和多相共存的特点有关,主要包括: 溶胶的动力学性质——布朗运动 溶胶的光学性质——丁达尔效应 溶胶的电学性质——电泳溶胶的动力学性质—布朗运动第三节第三节光线照射到物体表面时,可能产生三种情况: 颗粒直径远大于入射光波长(φ>λ)时,入射光被完全反射 颗粒直径小于入射光波长(φ<λ)时,发生光的散射作用而出现丁达尔现象。 当颗粒直径远小于入射光波长时(φ<<λ),散射极弱, 发生透射作用(溶液)第三节溶胶的电学性质—电泳带正电荷移向→阴极 带负电荷移向→阳极溶胶粒子带电的主要原因:胶体的应用动力学稳定性促使胶体聚沉的几种方法②加入带相反电荷的胶体 两种带相反电荷的胶体以适当比例相互混合,也能聚沉。 ③加热使胶体聚沉 通过加热,使胶体温度升高,增大胶体粒子的运动速度,加大相互碰撞机会,使胶体容易聚沉。高分子化合物:一般指摩尔质量MB>1000kg·mol-1的有机大分子化合物。包括天然高分子化合物(如蛋白质、淀粉、核酸、纤维素等)和合成的高分子化合物(如橡胶、塑料)。与小分子溶液一样是热力学平衡体系,但同时具有胶体溶液的若干性质 遵从相律,当温度降低时,溶质会自动析出,建立溶解平衡,但过程缓慢 柔性链高分子溶液的粘度比小分子溶剂的粘度要大得多,5%的天然橡胶-苯溶液已是冻胶。共同性质盐析:加入大量电解质使高分子化合物聚沉的作用。 主要原因:高分子的稳定性主要来自高度的水化作用,当加入大量电解质时,除中和了大分子所带电荷外,更重要的是电解质离子发生强烈地水化作用,使原来高度水化的高分子去水化,失去稳定性而沉淀析出。也称为去溶剂化作用。 应用:分离蛋白质和其他物质。高分子对溶胶的保护作用配位化合物的基础知识最早的配合物是单独地、偶然地被发现 1693年发现的铜氨配合物 1704年德国人迪士巴赫为研制颜料而得普鲁士蓝KFe[Fe(CN)6]3; 1760年发现的氯铂酸钾; 1798年法国化学家塔萨尔特(TassaertBM)无意中发现橙黄盐[Co(NH3)6]Cl3 1893年,WernerA提出维尔纳学说.叶绿素分子骨架血红素B分子结构由简单阳离子(或原子)和一定数目的中性分子(或阴离子)通过配位键相结合,并按照一定的组成和空间构型所形成的复杂离子或分子化合物称为配离子或配位分子。 含有配离子或配位分子的化合物称为配位化合物,简称配合物 配合物核心部分是配离子,基本结构特征是配位键第五章[Cu(NH3)4]SO41.内界 在配合物化学式中用方括号表示内界。 内界能稳定地存在于晶体及水溶液中,是配合物的特征部分,如:[Cu(NH3)4]2+ 2外界 内界以外的其他离子如SO42-写在方括号外,构成配合物的外界。 内界与外界之间的结合力是离子键,在溶液中内、外界分别以离子状态存在于溶液中。 配位分子没有外界。3.中心离子(或中心原子) 配合物的结构比较复杂,它都有一个金属离子或原子作为整个配合物的核心(占据化合物结构的中心位置)称作中心离子或中心原子。一般是过渡金属离子、原子以及B、Si、P等非金属离子4.配位体和配位原子 在中心离子周围结合一定数目的中性分子或阴离子,称配位体。 在配位体中,提供孤对电子并与中心离子直接连结的原子(如NH3中的N)称为配位原子。常见的配位原子:F、Cl、Br、I、C、N、P、O、S 直接同中心离子结合的配位原子的数目称为中心离子的配位数,常见的配位数为2、4、6。 1.配合物[Fe(en)3]Cl3,其配位体是_________,中心离子是_________。 2.配合物[Co(NH3)4(H2O)2]Cl3,其中心离子是_________,配位体是______________ 3.[PtCl2(NH3)2]的配位体是________,配位原子是_________。1.简单配合物 由单齿配体与中心原子形成的配合物服从一般

王子****青蛙
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















