课件-山东-2018_山东省泰安市2019中考化学复习 第一部分 基础过关 第七单元 溶液 第1课时 溶液的形成和定量表示课件.ppt
 立即下载
立即下载




如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
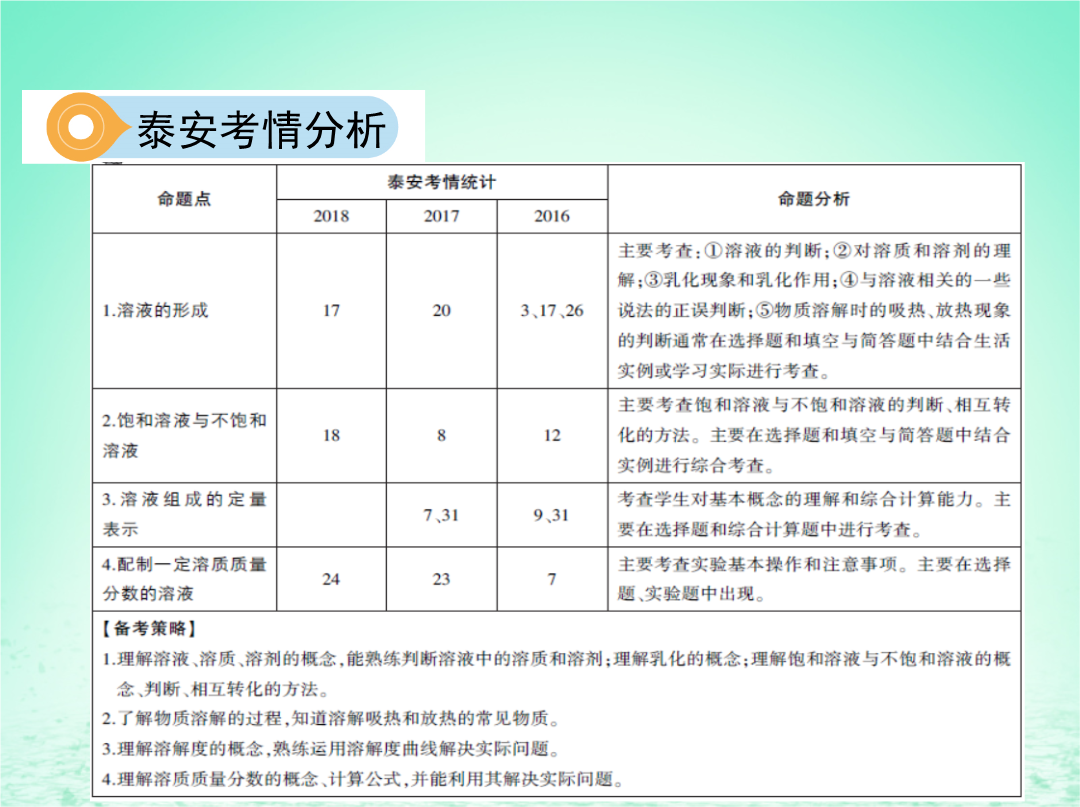
第七单元溶液第1课时溶液的形成和定量表示泰安考情分析泰安考情分析基础知识过关知识点一溶解的过程和乳化现象3.溶液的组成:溶液是由⑥溶质和⑦溶剂组成的。5.乳化作用乳化并不是溶解,只是使植物油分散成 小液滴存在水中而不聚集,生活中常用的乳化剂有肥皂、洗洁精等。乳化过程中,肥皂等物质起到 乳化作用。6.污垢去除方法比较知识点二物质溶解时的吸、放热现象知识点三饱和溶液和不饱和溶液知识点四溶液组成的定量表示3.溶液稀释的计算(1)依据:溶液稀释前后,溶质的质量 不变。(2)计算公式:浓溶液的质量×浓溶液中溶质的质量分数=稀溶液的质量×稀溶液中溶质的质量分数。特别提醒(1)同种溶质的不同溶质质量分数的溶液相互混合时,混合后的溶质质量等于混合前各溶液中溶质质量之和,溶剂质量等于混合前各溶液中溶剂质量之和,溶液质量等于混合前各溶液质量之和。(2)不同溶质的溶液相互混合时,溶液质量等于混合前各溶液质量之和,每一种溶质的溶质质量分数= ×100%。知识点五配制一定溶质质量分数的溶液(详见核心实验突破)实验配制一定溶质质量分数的溶液 3.溶液配制过程中的误差分析4.用浓溶液配制稀溶液的方法 (1)配制该溶液需要氯化钠10g,蒸馏水90mL。(水的密度为1.0g/mL)(2)指出图中一处明显错误的操作:托盘天平的砝码和称量物位置颠倒。改正操作后,用上述图示的序号表示配制溶液的正确操作顺序为⑤③④②①。(3)图①中玻璃棒搅拌的目的是加快氯化钠的溶解。(4)配制时应选择100(填“10”“50”或“100”)mL的量筒来量取所需的水。读数时,若俯视读数,其他操作都准确无误,则所配溶液溶质质量分数将大于10%。(填“大于”“小于”或“等于”)(5)称量时如果用质量为23.1g的烧杯盛放固体,在托盘天平上已放30g的砝码,则游码位置应是图2中的B(填字母序号)。解析(1)溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为10%的氯化钠溶液,需氯化钠的质量=100g×10%=10g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-10g=90g(合90mL)。(2)托盘天平的使用要遵循“左物右码”的原则,图③中所示操作砝码与药品位置放反了。配制溶质质量分数一定的溶液的基本步骤是:计算、称量(量取)、溶解,故配制100g溶质质量分数为10%的氯化钠溶液的正确操作顺序是⑤③④②①。(3)图①是溶解操作,玻璃棒搅拌的目的是加快氯化钠的溶解速率。(4)选取量筒时,尽量选用能一次量取的最小规格的量筒。用量筒量取90mL水,应选择100mL的量筒。量取水时俯视读数,会使量取水的体积小于90mL,则所得溶液的溶质质量分数大于10%。(5)称量时如果用质量为23.1g的烧杯盛放固体,称量的氯化钠的质量为10g,即称量的总质量为33.1g,在托盘天平上已放30g的砝码,游码的质量应为3.1g,则游码位置应是图中的B。 (1)用图1中的序号表示配制溶液的正确操作顺序:②③①⑤④。(2)若③中游码读数为1.2,则他称取NaCl的质量是5.8g。(3)按照图③称量的药品来配制溶液,该同学需要用水的体积是52.2mL。(水的密度为1.0g/mL)(4)他按图2量取水的体积,若其他操作步骤均无误差,则其所配溶液溶质质量分数小于(填“大于”“等于”或“小于”)10%。(2)若③中游码读数为1.2,则他称取NaCl的质量是5.8g。(3)按照图③称量的药品来配制溶液,该同学需要用水的体积是52.2mL。(水的密度为1.0g/mL)(4)他按图2量取水的体积,若其他操作步骤均无误差,则其所配溶液溶质质量分数小于(填“大于”“等于”或“小于”)10%。解析(1)配制一定溶质质量分数的氯化钠溶液,首先计算配制溶液所需NaCl和水的质量,再称量所需的NaCl和量取水,最后进行溶解,正确操作顺序为②③①⑤④。(2)由左盘中药品的质量=右盘中砝码的质量+游码的质量可知,若③中游码读数为1.2,则称取NaCl的质量=5g+2g-1.2g=5.8g。(3)溶质质量=溶液质量×溶质的质量分数,配制溶质质量分数为10%的NaCl溶液,氯化钠溶液的质量=5.8g÷10%=58g。溶剂质量=溶液质量-溶质质量,则所需水的质量=58g-5.8g=52.2g(合52.2mL)

一条****杉淑
 实名认证
实名认证
 内容提供者
内容提供者
最近下载
最新上传
2024年安徽省六安市金寨县二级建造师考试水利水电工程管理与实务考前冲刺试卷及答案.docx
2024年安徽省六安市金寨县二级建造师考试水利水电工程管理与实务考前冲刺试卷完整版.docx
2025年高考河南省化学真题试卷(网络收集版).pdf
2025年高考江苏卷物理真题(网络收集版).pdf
2025年高考山东地理真题(网络收集版).pdf
2025年高考山东卷物理真题(网络收集版).pdf
2025高考广西卷物理真题及答案(网络收集版).pdf
2025年高考安徽卷化学真题及答案(网络收集版).pdf
2025年黑吉辽蒙化学高考真题试卷及答案-黑龙江卷(网络收集版).pdf
2025年高考云南省物理真题及答案(网络收集版).pdf


















