



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
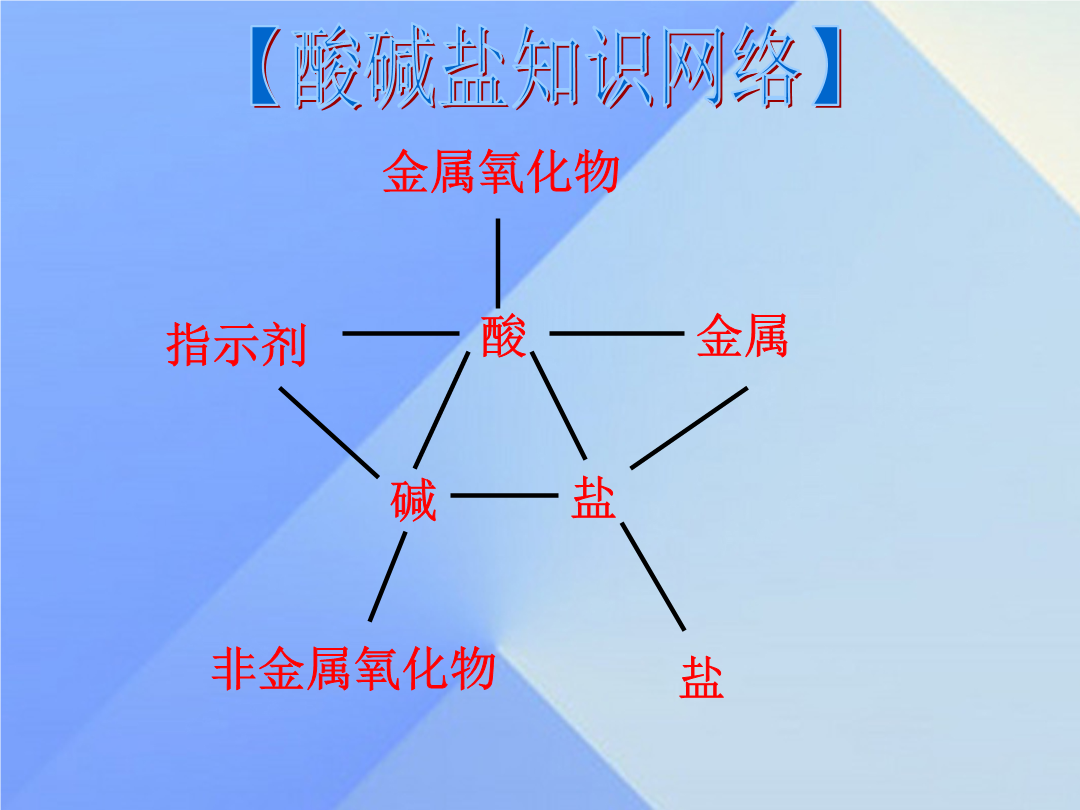
专题五生活中常见的化合物【考试要求】酸【知识梳理】【知识梳理】【知识梳理】【知识梳理】【知识梳理】【知识梳理】【知识梳理】【考点聚焦】【考点3中和反应及应用】例8.某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂.因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。Ⅰ、写出该中和反应的化学方程式:___________.Ⅱ、探究烧杯内溶液中溶质的成分.【提出问题】该烧杯内溶液中的溶质是什么?【猜想】猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;猜想三:____.【查阅资料】氯化钙溶液呈中性。【进行实验】实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡。实验现象:_________________结论:猜想一不正确实验步骤:实验步骤取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量实验现象:____________.结论:猜想二不正确,猜想三正确.【反思与拓展】(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑____________.(2)根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验?_________(填序号)a.pH试纸b.铜c.紫色石蕊溶液d.硝酸银溶液(3)烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是_______(写一条)。要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的_________。【点拨】:本题考查了酸碱中和反应以及实验设计的能力.设计实验时,可以从反应后的产物和其有关的性质着手;注意氯化钙中的盐酸只能用碳酸钙除去,及检验时要注意氯离子的干扰。(1)氢氧化钙和盐酸反应生成了氯化钙和水,因此反应的方程式为:Ca(OH)2+2HCl=CaCl2+2H2O;(2)【猜想】反应可能是恰好反应,只有氯化钙(猜想二)、也可能是一种物质完全反应,另一种物质有剩余,若氢氧化钙过量,则含有氢氧化钙和氯化钙(猜想一);若盐酸过量,则含有盐酸和氯化钙(猜想三);(3)【反思与拓展】①因为反应可能是完全反应,也可能是其中的一种反应物过量,因此在分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物的用量;②因为烧杯内溶液中的溶质含有HCl显酸性,故用pH试纸测定pH应该小于7,能够使紫色的石蕊试液变成红色,但不能和排在氢后面的铜反应,虽然能够和硝酸银反应产生沉淀,但由于其中的氯化钙也能够和硝酸银产生相同的现象;③盐酸会与铁反应而将下水道腐蚀;除去盐酸且不能引入新的杂质,还要防止过量产生新的杂质,只能加碳酸钙。【考点4溶液酸碱性与溶液pH的关系】【考点5复分解反应及其发生的条件】【考点聚焦】【中考早体验】【中考早体验】4.(2015·乌鲁木齐)盐酸、硫酸、氢氧化钠和氢氧化钙是初中化学中常见的物质,它们有着较广泛的用途。(1)酸与碱之前能发生反应,写出一个上述四种物质之间能发生反应的化学方程式:。(2)氢氧化钙可以用来调节土壤的性,它的水溶液常用来检验气体的存在。(3)将一定量的稀硫酸与氢氧化钠溶液混合,滴入几滴酚酞溶液,混合液显红色,可推断该溶液的pH7(填“>”、“<”或“=”)。要准确测定该溶液的pH,需要用到的仪器是。【中考早体验】(1)如用湿润的pH试纸测定盐酸的pH,则结果会_________(填“偏大”、“偏小”、“无影响”)。(2)图中①的现象是:__________________________。(3)写出一个符合图中③的化学方程式____________________。(4)图中性质④属于_____________反应(填基本反应类型)。(5)图中⑤的性质在工业上可用于_______________(填用途)。【中考早体验】【中考早体验】【中考早体验】【中考早体验】谢谢!

An****99
 实名认证
实名认证
 内容提供者
内容提供者
最近下载
贵州省城市管理行政执法条例.doc
贵州省城市管理行政执法条例.doc
一种基于双轨缆道的牵引式雷达波在线测流系统.pdf
一种基于双轨缆道的牵引式雷达波在线测流系统.pdf
一种胃肠道超声检查助显剂及其制备方法.pdf
201651206021+莫武林+浅析在互联网时代下酒店的营销策略——以湛江民大喜来登酒店为例.doc
201651206021+莫武林+浅析在互联网时代下酒店的营销策略——以湛江民大喜来登酒店为例.doc
用于空间热电转换的耐高温涡轮发电机转子及其装配方法.pdf
用于空间热电转换的耐高温涡轮发电机转子及其装配方法.pdf
用于空间热电转换的耐高温涡轮发电机转子及其装配方法.pdf


















