

如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
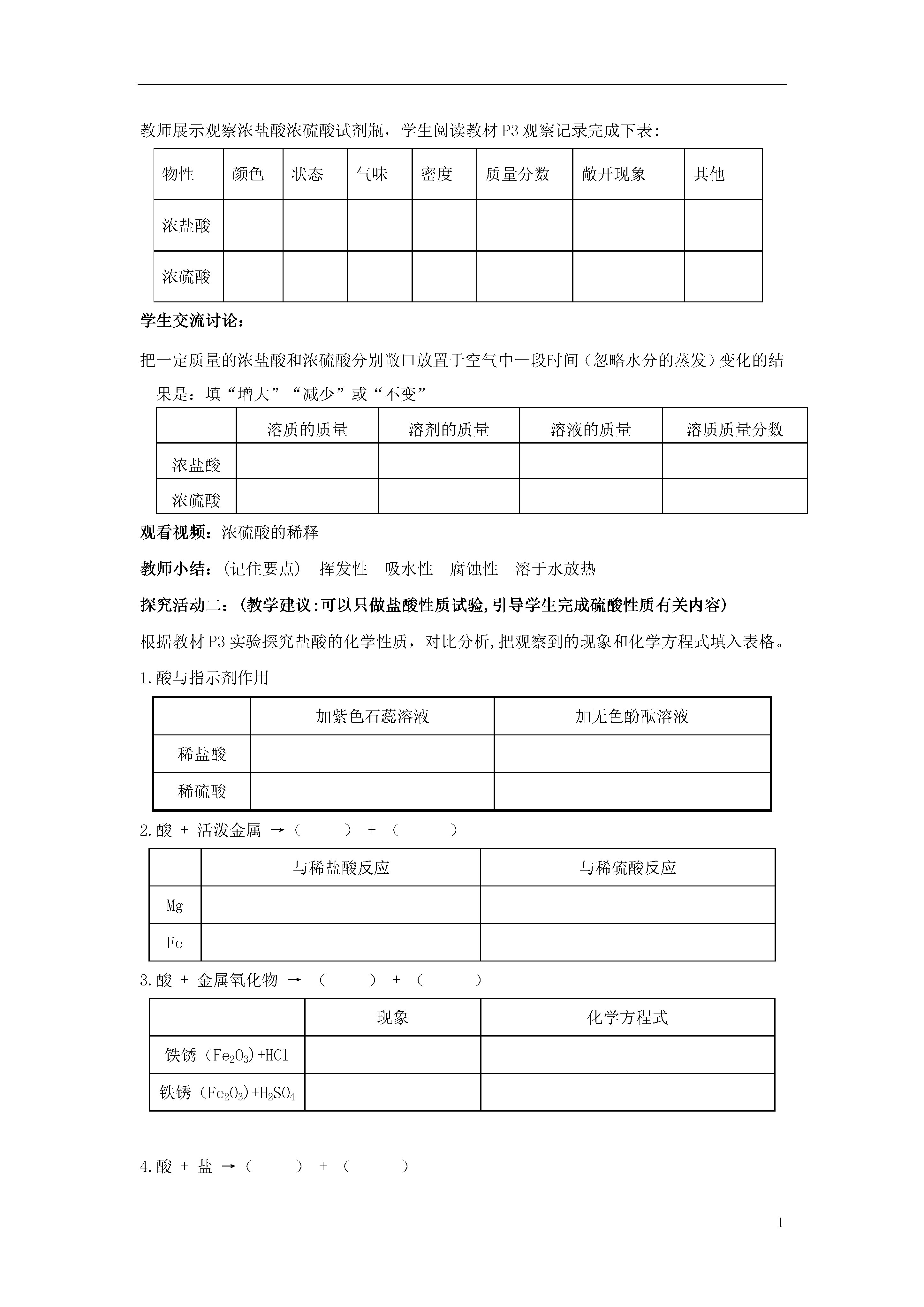
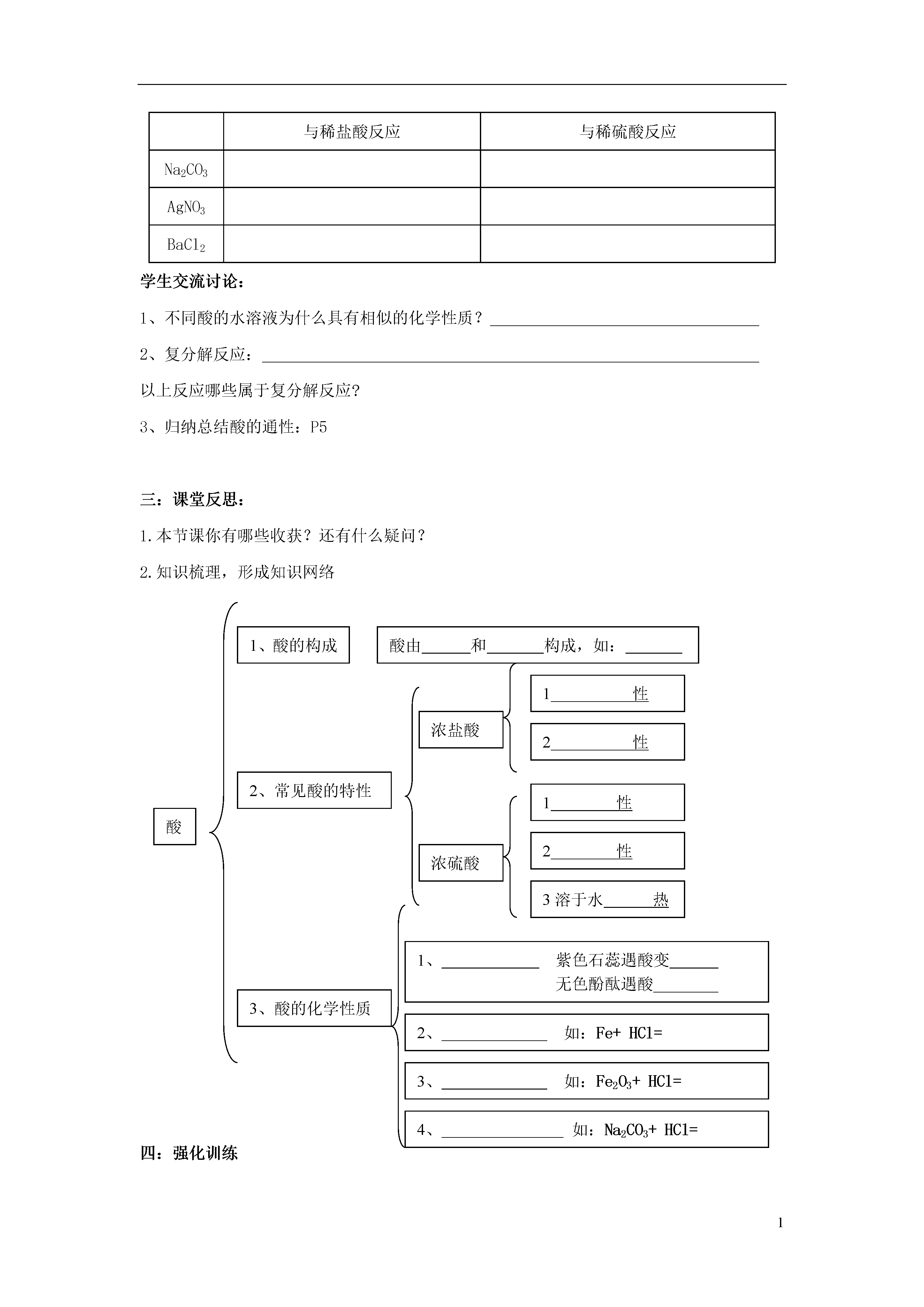
1第一节酸及其性质【学习目标】1、知道浓盐酸和浓硫酸的物理性质,学会其使用方法。2、记住酸的化学性质,理解酸的化学性质实质是氢离子的性质。3、初步认识和判断复分解反应,会写常见复分解反应的化学方程式。4、通过对酸性质的开放性探究活动,引领学生进一步发展科学探究能力。通过对比分析培养学生归纳及逻辑推理能力。【学习重点】酸的化学性质及化学方程式。【学习难点】理解酸的化学性质实质是氢离子的性质。【学习过程】一:课前自主学习自学教材P2-P6,完成以下问题1、酸由和两部分构成.2、读写以下酸(写化学式)盐酸硫酸硝酸醋酸碳酸3、盐由和两部分构成,如:4、从哪些方面认识浓盐酸和浓硫酸的物理性质浓盐酸和浓硫酸应保存,原因是5、在稀释浓硫酸时一定要把沿器壁慢慢注入,并不断搅拌。如果不慎将浓硫酸沾到皮肤上,应怎样处理?6、读写P4-P5有关化学方程式7、不同酸的水溶液具有相似的化学性质的原因是8、叫做复分解反应二:课堂助学导入新课:酸是生产生活中常见的物质,通过本节课学习我们深入了解和认识这类物质探究活动一:(教学建议:实物展示和投影相结合)教师展示观察浓盐酸浓硫酸试剂瓶,学生阅读教材P3观察记录完成下表:物性颜色状态气味密度质量分数敞开现象其他浓盐酸浓硫酸学生交流讨论:把一定质量的浓盐酸和浓硫酸分别敞口放置于空气中一段时间(忽略水分的蒸发)变化的结果是:填“增大”“减少”或“不变”溶质的质量溶剂的质量溶液的质量溶质质量分数浓盐酸浓硫酸观看视频:浓硫酸的稀释教师小结:(记住要点)挥发性吸水性腐蚀性溶于水放热探究活动二:(教学建议:可以只做盐酸性质试验,引导学生完成硫酸性质有关内容)根据教材P3实验探究盐酸的化学性质,对比分析,把观察到的现象和化学方程式填入表格。1.酸与指示剂作用加紫色石蕊溶液加无色酚酞溶液稀盐酸稀硫酸2.酸+活泼金属→()+()与稀盐酸反应与稀硫酸反应MgFe3.酸+金属氧化物→()+()现象化学方程式铁锈(Fe2O3)+HCl铁锈(Fe2O3)+H2SO44.酸+盐→()+()与稀盐酸反应与稀硫酸反应Na2CO3AgNO3BaCl2学生交流讨论:1、不同酸的水溶液为什么具有相似的化学性质?2、复分解反应:以上反应哪些属于复分解反应?3、归纳总结酸的通性:P5三:课堂反思:1.本节课你有哪些收获?还有什么疑问?2.知识梳理,形成知识网络酸由和构成,如:1、酸的构成1性2性浓盐酸1性2、常见酸的特性2性酸浓硫酸3溶于水热1、紫色石蕊遇酸变无色酚酞遇酸2、如:Fe+HCl=3、酸的化学性质3、如:Fe2O3+HCl=4、如:Na2CO3+HCl=四:强化训练1、含下列离子的溶液中,溶质全部为酸的是()A.H+Na+SO42-B.AgK+NO3-C.OH-K+Ba2+D.H+Cl-NO3-2、下列几种溶液久置于空气中,溶质成分不变,但溶质的质量分数减小,且溶液质量增加的是()A.浓硫酸B.浓盐酸C.食盐水D.石灰水3、下列关于物质的用途的叙述不正确的是()A.盐酸可用来除铁锈B.稀硫酸在实验室里常用作干燥剂C.硫酸可用于精炼石油和金属除锈D.盐酸是重要化工产品4、如图所示,导管内有一段红墨水,试管中盛有适量的冷水,容器的气密性良好.现往试管中加入下列某种物质,红墨水不会移动的是()A.NaOH固体B.蔗糖C.浓硫酸D.硝酸铵5、稀盐酸和稀硫酸具有许多相似化学性质的原因是()A.它们都是溶液B.它们都含有酸根离子C.它们都含有氢元素D.它们都电离出了H+6、下列方程式书写完全正确的是()A.Zn+2HCl=ZnCl2+H2↑B.2Fe+3H2SO4=Fe2(SO4)3+3H2↑C.Al+HCl=AlCl3+H2↑D.Fe2O3+H2SO4=FeSO4+H2O7、盛浓硫酸的铁槽,用水冲洗时遇明火爆炸,用化学方程式解释原因。(1)____________________________________;(2)____________________________________。8、小明学习了盐酸、硫酸后,知道它们的化学性质有许多相似之处。由此他想通过实验探究食醋中的主要成分醋酸的化学性质。他的推测可能有哪些?(写出两点即可)(1)_______________________________________________。(2)_______________________________________________。
Ta的资源

2025年铜鼓县二级建造师考试水利水电工程管理与实务点睛提分卷完整版

2025年铜陵市铜官山区人力资源管理师四级理论知识高分通关卷完整版

2025年铜陵市狮子山区人力资源管理师四级理论知识预测试卷完整版

2025年铜川市人力资源管理师二级理论知识深度预测试题含解析

2025年铜川市二级建造师考试水利水电工程管理与实务全真模拟试卷含解析

2025年铜仁地区印江土家族苗族自治县人力资源管理师四级理论知识全真模拟试卷(附答案及解析)

2025年铜仁地区沿河土家族自治县二级建造师考试水利水电工程管理与实务统考试题含解析

2025年铜仁地区印江土家族苗族自治县二级建造师考试水利水电工程管理与实务全真模拟试题完整版

2025年铜仁地区印江土家族苗族自治县人力资源管理师二级理论知识高分冲刺试题及答案

2025年铜仁地区万山特区人力资源管理师二级理论知识临考冲刺试题(附答案及解析)

慧颖****23
 实名认证
实名认证
 内容提供者
内容提供者
最近下载
最新上传
2025年银川市金凤区二级建造师考试水利水电工程管理与实务全真模拟试题含解析.docx
2025年铜鼓县人力资源管理师四级理论知识统考试题完整版.docx
2025年铜鼓县人力资源管理师四级理论知识点睛提分卷完整版.docx
2025年银川市金凤区人力资源管理师四级理论知识点睛提分卷及答案.docx
2025年铜鼓县人力资源管理师四级理论知识深度预测试卷完整版.docx
2025年银川市金凤区二级建造师考试水利水电工程管理与实务全真模拟试卷含解析.docx
2025年铜鼓县人力资源管理师四级理论知识深度预测试题完整版.docx
2025年银川市金凤区人力资源管理师四级理论知识深度预测试题及答案.docx
2025年铜鼓县人力资源管理师四级理论知识深度自测卷完整版.docx
2025年铜鼓县人力资源管理师二级理论知识预测试题(附答案及解析).docx








