

如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
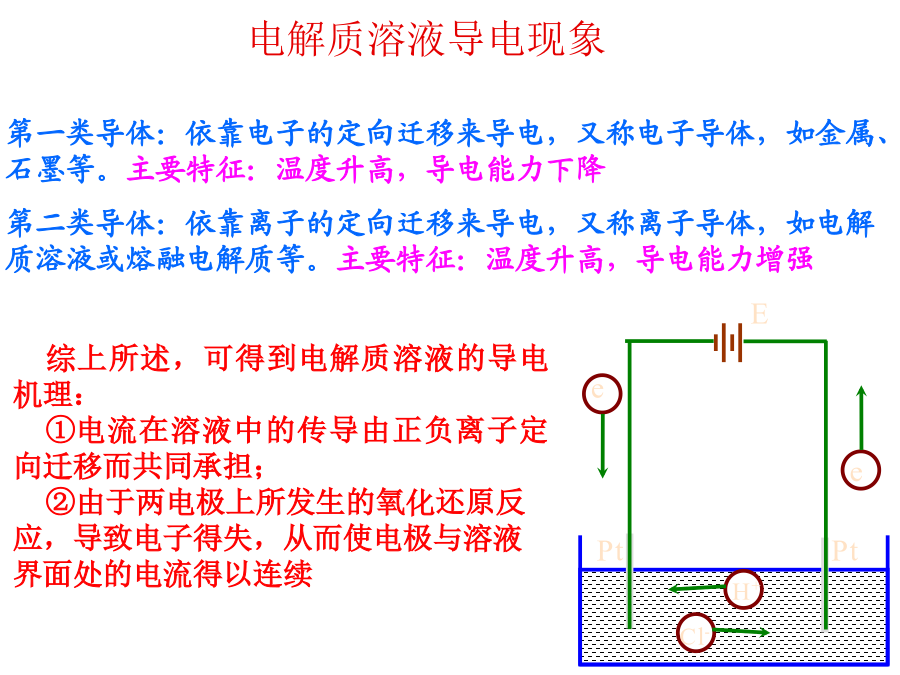
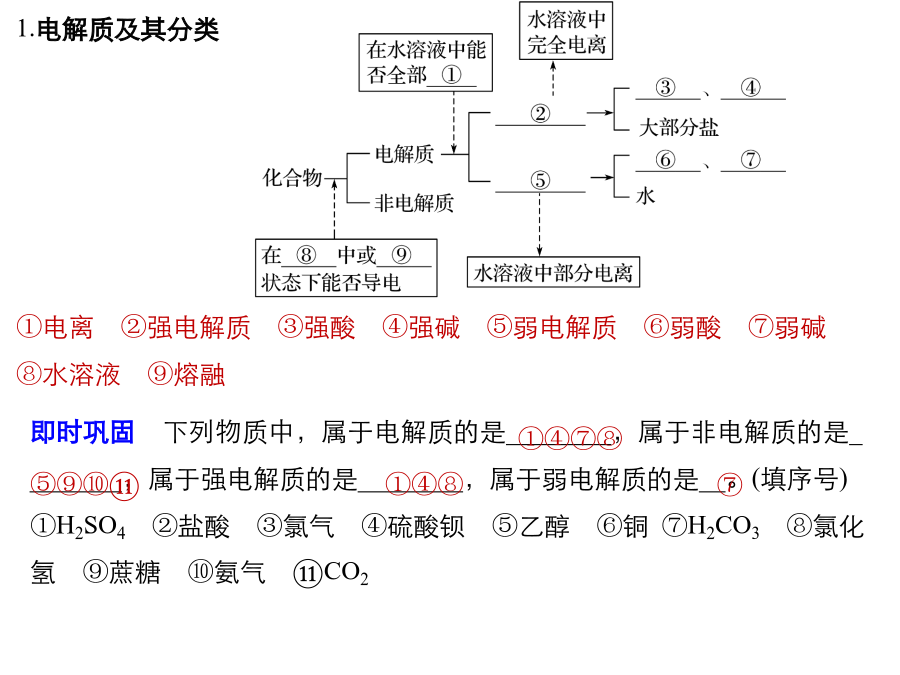
【学习目标】 1、电解质、非电解质、强电解质、弱电解质等概念 2、离子反应的本质 3、离子方程式的书写和正误判断 4、离子共存 5、离子反应的推断题 6、简单计算(物质的量守恒、电荷守恒)电解质溶液导电现象①电离②强电解质③强酸④强碱⑤弱电解质⑥弱酸⑦弱碱⑧水溶液⑨熔融2.熟记常见的强电解质和弱电解质 (1)强电解质 强酸:H2SO4、HNO3、HCl、HBr、HI、HClO4 强碱:NaOH、KOH、Ba(OH)2 盐:盐不论难溶、易溶,大多数盐都是强电解质 (2)弱电解质 弱酸:CH3COOH、HClO、HF、HCN、H2SO3、H2S、H2CO3、H3PO4 弱碱:NH3·H2O 水及少数盐,如(CH3COO)2Pb3.电离方程式的书写 (1)电离:电解质在水溶液中或熔融状态下,离解成的离子的过程。 (2)电离方程式 ①强电解质完全电离,用“”表示,写出下列物质在水溶液中的电离方程式。 H2SO4: ; NaOH: ; (NH4)2SO4: ; BaSO4: ; KAl(SO4)2: 。②弱电解质部分电离,用“ ”表示,多元弱酸的电离分步书写,多元弱碱的电离一步完成。 写出下列物质在水溶液中的电离方程式: NH3·H2O: ; H2CO3: 。 ③酸式盐的电离。多元强酸酸式盐与多元弱酸酸式盐的阴离子电离方式不同。 写出下列物质在水溶液中的电离方程式: NaHSO4: ; NaHCO3: 。例1、下列物质在水溶液中导电能力强弱顺序是: 0.01mol/LNH3·H2OB.0.01mol/LNaHCO3 C.0.01mol/LNa2CO3D.0.2mol/LMgSO4 E.1mol/LCH3COOH(假设pH=1) 答案:D>E>C>B>A 小结:只有相同温度、浓度时,强电解质的导电能力才强 电解质的导电能力强弱决定于离子浓度的大小、离子所带的电荷归纳小结 二、离子反应(1)、生成难溶物质—沉淀 ①酸:②碱:③盐:(强)氧化剂:水解反应:“一色”:若要求是无色溶液,则Cu2+(蓝)、Fe3+(黄)、Fe2+(淡绿)、MnO4-(紫)、Fe(SCN)2+(血红)、Fe(C6H5O)63-(紫)等有色金属离子、酸根离子和非金属单质分子如Br2、I2等均不能大量存在。“三特”:判断离子共存应注意下列三种特殊问题:(4)四反应——四种反应类型: 指离子间通常能发生的四种类型的反应,能相互反应的离子显然不能大量共存。离子方程式的定义:用实际参加反应的离子的符号来表示离子反应的式子叫离子方程式。 离子方程式的意义:不仅可以表示一个反应,而且可以表示所有同一类型的离子反应1.浓盐酸与铁屑反应: 2.钠与CuSO4溶液反应: 3.NaHCO3溶液与稀H2SO4反应: 4.向FeCl3溶液中加入Mg(OH)2:规范书写·培养答题能力(5)石灰乳与Na2CO3溶液反应 。 (6)将浓硝酸滴到CaCO3固体上 。 (7)Na2SO4溶液与AgNO3溶液混合 。 (8)NH4Cl与NaOH两稀溶液混合 。2.完成下列教材中重要氧化还原反应的离子方程式 (1)用MnO2与浓盐酸共热制Cl2 。 (2)用NaOH吸收Cl2 。 (3)铜分别溶于浓、稀硝酸 ; 。2.强化记忆盐、碱溶解性 钾、钠、铵盐、硝酸盐都易溶; 硫酸盐不溶铅和钡;盐酸盐不溶银亚汞; 微溶物有四种;强碱都易溶,Ca(OH)2是微溶。 说明:(1)四种微溶物是指Ag2SO4、CaSO4、MgCO3、Ca(OH)2。(2)AgCl、AgBr、AgI、BaSO4及微溶的CaSO4、Ag2SO4都难溶于稀强酸。完成下列反应的离子方程式 (1)Ba(OH)2溶液与H2SO4溶液混合 。 (2)Ba(OH)2溶液与(NH4)2SO4溶液混合 。 (3)CuSO4溶液与Ba(OH)2溶液混合 。用分类思想突破和量有关的离子方程式题组一连续型 1.指反应生成的离子因又能跟剩余(过量)的反应物继续反应而跟用量有关。 (1)可溶性多元弱酸(或其酸酐)与碱溶液反应。如CO2通入NaOH溶液中: 碱过量: ; 碱不足: 。 (2)多元弱酸(或其酸酐)与更弱酸的盐溶液反应。如CO2通入NaAlO2溶液中: NaAlO2过量: ; NaAlO2不足: 。(3)多元弱酸盐与强酸反应。如Na2CO3溶液与稀盐酸: 盐酸不足: ; 盐酸过量: 。 (4)铝盐溶液与强碱溶液反应 铝盐过量: ; 强碱过量: 。 (5)NaAlO2溶液与强酸溶液反应 NaAlO2过量: ; 强酸过量: 。(6)Fe与稀HN

YY****。。
 实名认证
实名认证
 内容提供者
内容提供者
最近下载
最新上传
浙江省宁波市2024-2025学年高三下学期4月高考模拟考试语文试题及参考答案.docx
汤成难《漂浮于万有引力中的房屋》阅读答案.docx
四川省达州市普通高中2025届第二次诊断性检测语文试卷及参考答案.docx
山西省吕梁市2025年高三下学期第二次模拟考试语文试题及参考答案.docx
山西省部分学校2024-2025学年高二下学期3月月考语文试题及参考答案.docx
山西省2025年届高考考前适应性测试(冲刺卷)语文试卷及参考答案.docx
全国各地市语文中考真题名著阅读分类汇编.docx
七年级历史下册易混易错84条.docx
湖北省2024-2025学年高一下学期4月期中联考语文试题及参考答案.docx
黑龙江省大庆市2025届高三第三次教学质量检测语文试卷及参考答案.docx