



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
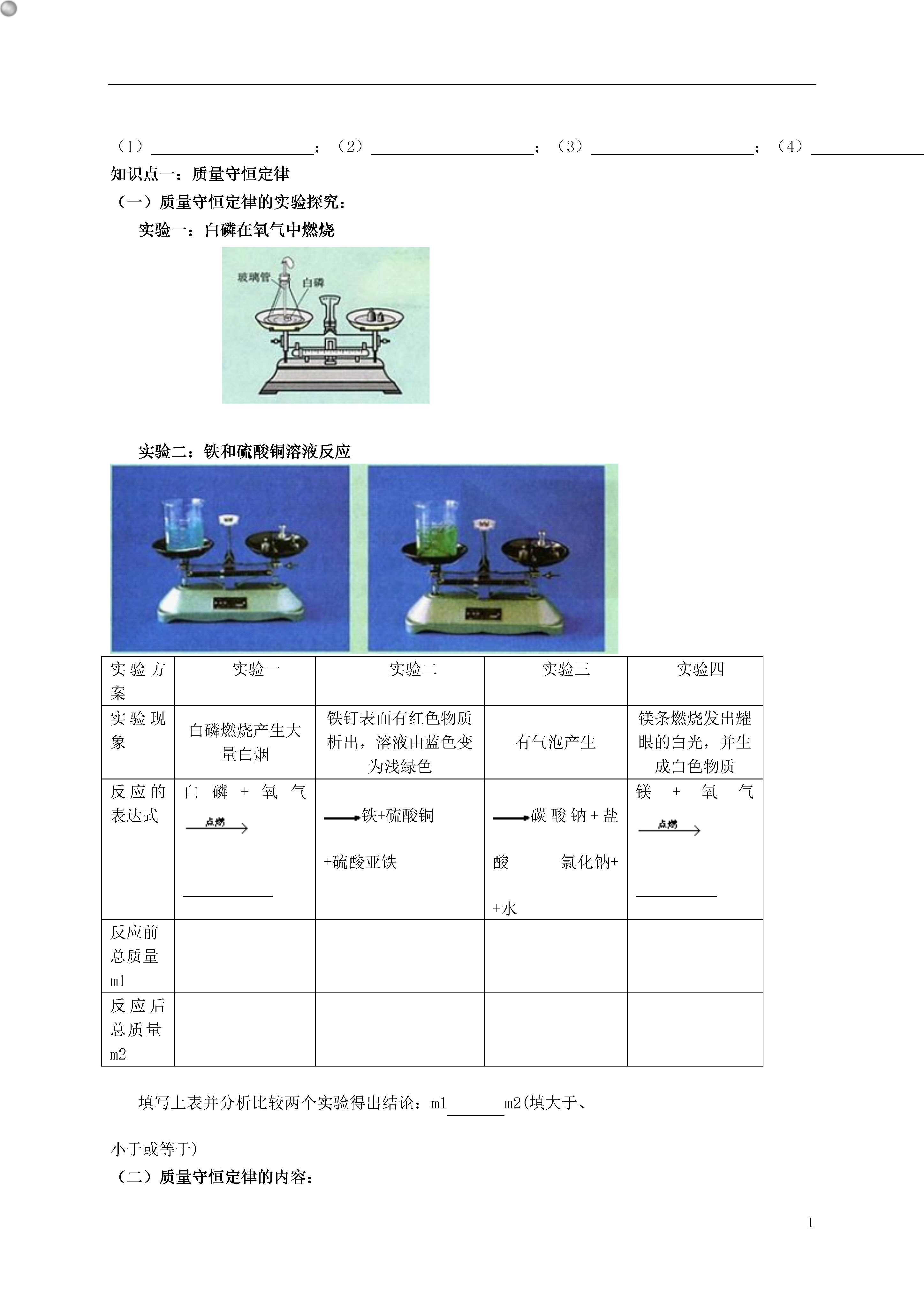
1质量守恒定律一、目标与策略明确学习目标及主要的学习方法是提高学习效率的首要条件,要做到心中有数!学习目标:认识质量守恒定律;从微观的角度认识在化学反应中原子的种类和数目不会发生改变;通过实验探究得出化学反应前后物质的总质量不变的结论;了解化学方程式的含义和读法,特别是各物质间的质量关系;能正确书写化学方程式,并能进行简单的质量关系的计算。重点难点:质量守恒定律的应用,化学方程式的书写。对质量守恒定律的微观认识,化学方程式的配平学习策略:此章是对化学用语的学习,要注意分清不同的符号代表的不同含义。学习了化学方程式可以自己总结一下以前学过的化学方程式,同时总结配平的好方法。二、学习与应用(一)100ml的水和100ml酒精放在一起,体积是200ml吗?为什么?如果改为100克的水和100克的酒精呢?为什么?(二)化学反应的本质是分子分裂成,重新结合形成新的过程。可见化学反应是分子可分,不可分。(三)下图是电解水中水分子分解过程示意图,请从宏观、微观两个方面写出获得的信息:(1);(2);(3);(4)。知识点一:质量守恒定律(一)质量守恒定律的实验探究:实验一:白磷在氧气中燃烧实验二:铁和硫酸铜溶液反应实验方案实验一实验二实验三实验四实验现象白磷燃烧产生大量白烟铁钉表面有红色物质析出,溶液由蓝色变为浅绿色有气泡产生镁条燃烧发出耀眼的白光,并生成白色物质反应的表达式白磷+氧气铁+硫酸铜+硫酸亚铁碳酸钠+盐酸氯化钠++水镁+氧气反应前总质量m1反应后总质量m2填写上表并分析比较两个实验得出结论:m1m2(填大于、小于或等于)(二)质量守恒定律的内容:参加化学反应的各物质的总和等于反应后生成的各物质的总和。思考:所有反应都遵循质量守恒定律吗?实验三:把盛有盐酸的小试管放入装有碳酸钠粉末的小烧杯中,放在天平上,如图13-3所示,加砝码调节平衡;小心把小烧杯倾斜,使盐酸与碳酸钠接触,发现有气泡冒出,反应一段时间后,把小烧杯放在托盘上,观察。实验四:称量一段放在石棉网上的打磨光亮的镁条,记录数据m1;然后点燃镁条,如图13-4所示,观察现象,将生成物收集在石棉网上,一起称量,记录数据m2。比较上面两个实验发现反应前后总质量不相等。上面两个实验是否说明质量不守恒吗?为什么?答:知识点二:质量守恒定律的微观解释及应用(一)质量守恒定律的实质:化学反应的实质是参加反应的各物质中的重新组合生成新物质的过程,在化学反应前后,的种类没有改变、没有增减、原子的也没有改变,如图13-5所示水分子的分解示意图。因此参加化学反应的各物质的质量总和与反应后生成的各物质的质量总和必然相等。以上可总结为“五个不变,两个改变,一个可能变。”(二)质量守恒定律的应用(1)解释常见化学现象中的质量关系,如:铁生锈质量增加,木炭燃烧成灰质量减少等。(2)利用质量守恒定律,根据化学方程式确定物质的化学式;(3)利用质量守恒定律,根据化学方程式确定物质的相对分子质量;(4)熟练进行化学方程式的配平;根据题中所给的信息,利用质量守恒定律写出未学过的化学反应方程式;根据化学方程式求某元素质量;(5)利用质量守恒定律,根据化学方程式求反应中某物质的质量;(6)结合化学方程式中各物质的质量比,判断某反应物是否全部参加了反应……知识点三:化学方程式(一)化学方程式:用化学式来表示化学反应的式子。(二)化学方程式提供的信息意义实例(S+O2SO2)①表示反应物、生成物以及反应条件反应物是和,生成物是二氧化硫,反应条件是②表示反应物、生成物之间的质量关系(即质量比)S+O2SO232:16×2:32+16×232:32:64即::(最简整数比)③表示反应物、生成物之间的粒子数关系(粒子个数比)S+O2SO21:1:1(三)化学方程式的读法(1)质的方面:硫和氧气在点燃条件下反应生成二氧化硫。(2)量的方面:每质量的硫和质量的氧气完全反应生成质量的二氧化硫。(3)粒子方面:每原子和分子反应生成1个二氧化硫分子。知识点四:化学方程式的书写(一)化学方程式的书写原则书写化学方程式必须同时体现以下原则:(1)必须以为依据,不能凭空臆造事实上不存在的物质和化学反应;(2)要遵守质量守恒定律。这一原则要求书写化学方程时一定要,使化学反应前的各种原子的个数。(二)化学方程式的书写步骤(以高锰酸钾受热分解为例)(1)写:根据事实写出反应物和生成物的化学式,并在反应物和生成物之间画一条短线(或标出一个指向生成物的箭头)。KMnO4──K2MnO4+MnO2+O2(2)配:配平化学方程式:在化

俊凤****bb
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















