



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
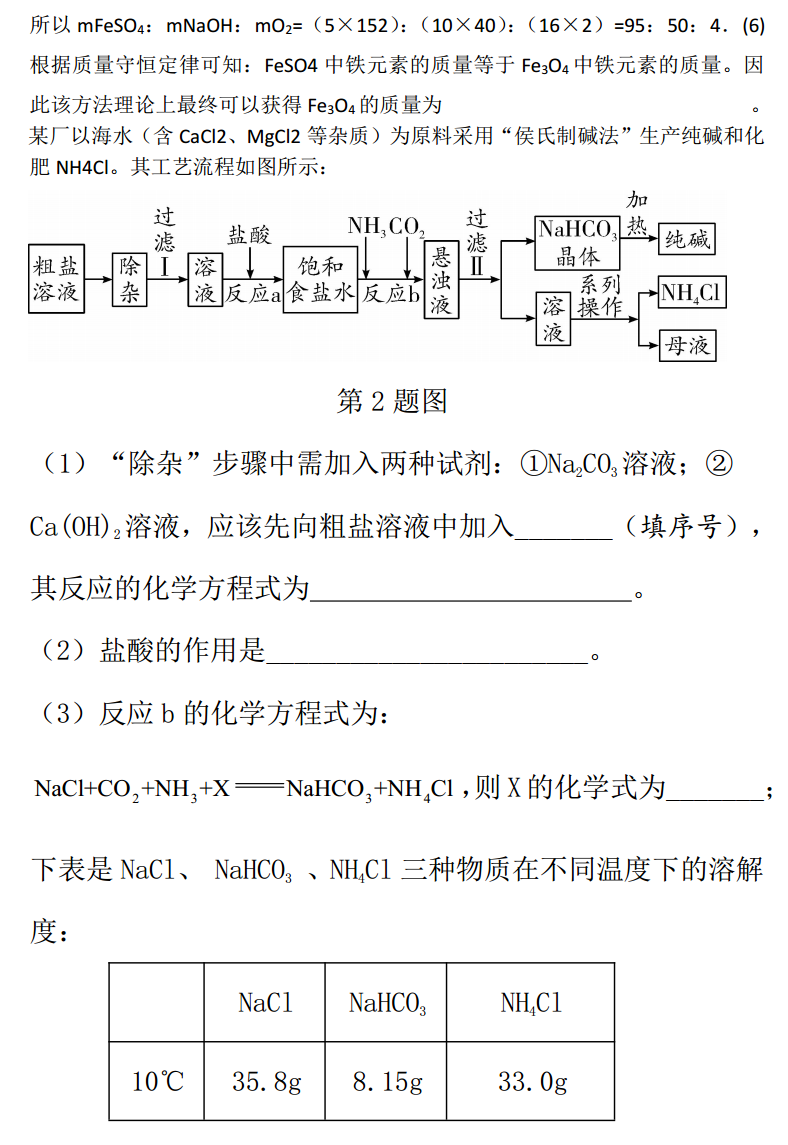
流程图题类型一物质制备流程图题1.以FeSO4为原料制备铁黑颜料Fe3O4(其中Fe既有+2价,也有+3价)的过程如图:()()(分解获得Fe3O4的反应为FeOH2+2FeOH3Fe3O4+4H2O)第1题图(1)沉淀为____色固体,化学式为:______________。(2)过滤后所得到的滤液中一定含有的离子是_______,要验证NaOH溶液是否过量,可向滤液中加入下列试剂中的______。①酚酞②硫酸铜③稀盐酸④铁粉(3)洗涤后得到固体在氧气和水的作用下生成氢氧化铁,该反应的化学方程式为_______________________。(4)“转化”过程中若参与反应的O2过量,则最终所得固体的质量_____(填“偏小”或“不变”或“偏大”)。(5)从后续反应过程来看,若要使原料不浪费,往FeSO4溶液中加入适量NaOH溶液和一定量空气时,应控制mFeSO4:mNaOH:mO2=(最简整数比)。(6)若原料中含FeSO49.12t,该方法理论上最终可以获得Fe3O4的质量为______。+2-(1)浅绿色Fe(OH)2(2)Na和SO4①②()═()(3)4FeOH2+O2+2H2O4FeOH3(4)偏大(5)95:50:4(6)4.64t【解析】(1)在FeSO4溶液中加入NaOH溶液,生成浅绿色絮状沉淀氢氧化亚铁,反应化学方程式为:();(2)如果氢FeSO4+2NaOHFeOH2+Na2SO4氧化钠溶液不足量,过滤后滤液为FeSO4和Na2SO4,如果氢氧化钠过量,过滤后滤液为Na2SO4和NaOH,所以过滤后所得到的滤液中一定含有Na2SO4;要验证NaOH过量,①加入酚酞,溶液会变红;②加入硫酸铜溶液,会产生蓝色沉淀;③加入稀盐酸,虽然发生化学反应,但是没有明显现象;④加入铁粉,不会发生反应。(3)过滤、洗涤后得到固体氢氧化亚铁与氧气和水反应生成氢氧化铁,反应的化学方程式为:()═()。(4)FeO中Fe既有+2价,也有+3价,4FeOH2+O2+2H2O4FeOH334说明FeSO4中的铁部分被氧化成+3价,若“转化”过程参与反应的O2过量,则最终所得固体为Fe2O3,也就是FeSO4中的铁全部被氧化成+3价,故质量偏大。(5)硫酸亚铁溶液、氢氧化钠和氧气反应生成氢氧化铁沉淀、氢氧化亚铁沉淀和硫酸钠,反应化学方程式为:()(),5FeSO4+10NaOH+2H2O+O2FeOH2+4FeOH3+5Na2SO4所以mFeSO4:mNaOH:mO2=(5×152):(109×.1420t):5(616×2)=9253:250:4.(6)×100%=4.64t根据质量守恒定律可知:FeSO4中铁元素的质量1等5于2Fe3O4中铁元5素6的3质量。因此该方法理论上最终可以获得Fe3O4的质量为。某厂以海水(含CaCl2、MgCl2等杂质)为原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl。其工艺流程如图所示:第2题图(1)“除杂”步骤中需加入两种试剂:①Na2CO3溶液;②Ca(OH)2溶液,应该先向粗盐溶液中加入_______(填序号),其反应的化学方程式为。(2)盐酸的作用是_______________________。(3)反应b的化学方程式为:NaCl+CO2+NH3+XNaHCO3+NH4Cl,则X的化学式为_______;下表是NaCl、NaHCO3、NH4Cl三种物质在不同温度下的溶解度:NaClNaHCO3NH4Cl10℃35.8g8.15g33.0g45℃37.0g14.0g50.0g①反应b的温度应该控制在_____(填“10℃”或“45℃”)左右。②10℃时,取11.7g食盐配成饱和溶液,向其中通入适量氨气后,再向其中通入二氧化碳,使反应进行完全.NaHCO3晶体析出________g。如果此时升高温度至45℃________(填“有”或“没有”)NaHCO3晶体析出。(4)若过滤Ⅱ操作后所得的溶液中的溶质只含有NH4Cl和NaCl,则系列操作具体是指蒸发浓缩、_______、过滤。(1)②2(2)除去过量的CaOH2+MgCl2MgOH2+CaCl碳酸钠溶液(3)H2O①10℃②14.43有(4)降温结晶(或冷却结晶)【解析】(1)碳酸钠可以将CaCl2沉淀下来;除MgCl2用氢氧化钙,所加试剂要过量,为了将多余的杂质除去,碳酸钠必须在氢氧化钙的后面添加,氢氧化钙与MgCl2生成氢氧化镁沉淀

葫芦****io
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















