



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
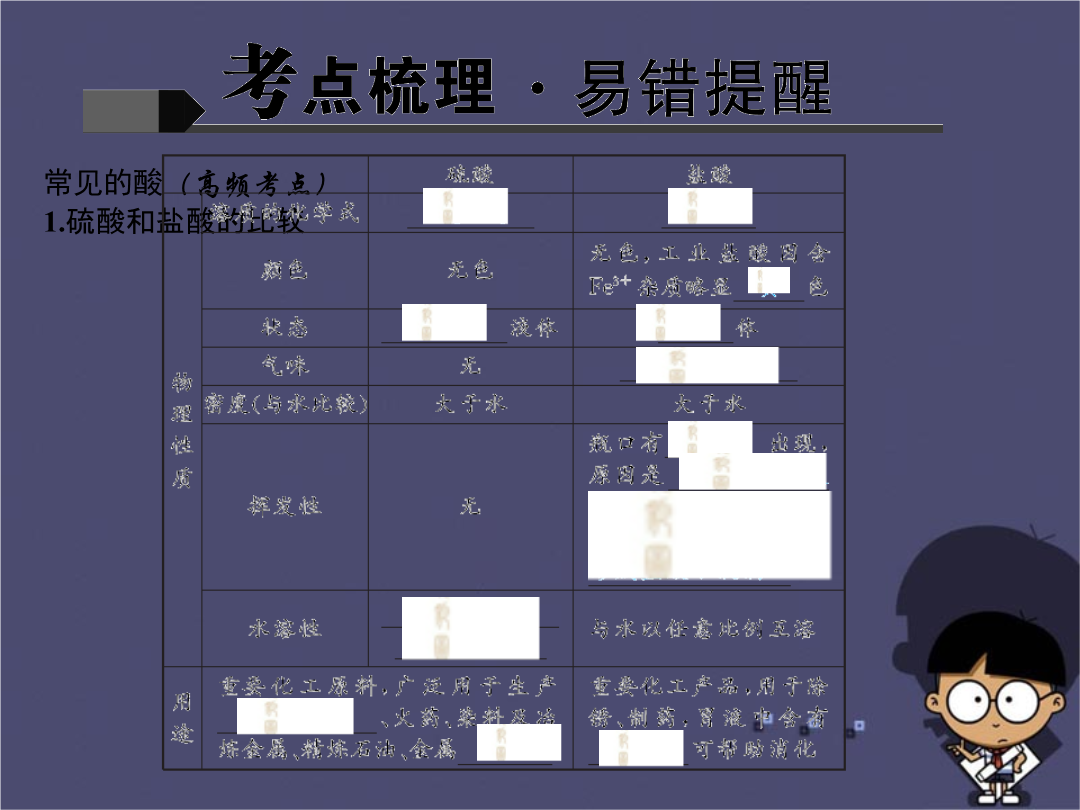
酸碱指示剂与pH(高频考点)1.常用的酸碱指示剂,如石蕊、酚酞,在不同的酸碱性溶液中显示不同的颜色。请把下表补充完整。2.填“一定”或“不一定”。(1)酸溶液是酸性溶液,酸性溶液是酸溶液。(2)碱溶液显碱性,碱性溶液是碱溶液。(3)盐溶液呈中性,呈中性的溶液是盐溶液。3.显酸性的溶液都含有离子,显碱性的溶液都含有离子。4.发生变色的是酸碱指示剂,而不是酸碱性溶液。5.溶液的酸碱度常用表示。pH范围通常在之间;pH7的溶液显酸性,pH,酸性越强;pH7的溶液显中性;pH7的溶液显碱性,pH,碱性越强。6.测定方法:用蘸取被测液,滴到上,pH试纸显色后与比较可得出溶液的pH(注意:用pH试纸测出的pH一般记整数,为粗略读数)。7.通过测定pH,可以了解空气污染情况、人体健康状况、促进农作物的生长等。正常雨水因溶有空气中略显性,酸雨pH;胃液的pH7;洗发液多呈性,护发素多呈酸性,因的环境利于头发的生长,所以使用时先用,后用。常见的酸(高频考点)1.硫酸和盐酸的比较2.浓硫酸的特性及稀释方法(1)吸水性:故可作剂,可以干燥(从H2、O2、CO2、CO、NH3中选择)。(2)强腐蚀性(也称为脱水性):如果不慎将浓硫酸沾在皮肤或衣服上,应立即用,然后涂上3%~5%的,若是稀硫酸,是否也要处理?。(3)强氧化性:浓硫酸与金属反应时一般生成水而不是氢气,因而实验室制H2时不用浓硫酸。(4)浓硫酸的稀释:一定要把沿器壁慢慢注入中,并用不断搅拌。且不可把;因为水的密度,在浓硫酸上面,溶解的热量会使水立即沸腾,使硫酸四处飞溅。3.酸的化学性质(酸5条)(1)与指示剂反应:能使紫色石蕊试液,使无色酚酞试液。(2)与活泼金属反应一般生成。如实验室制氢气的反应原理:。(3)与金属氧化物反应一般生成。如CuO+H2SO4===;Fe2O3+6HCl===。(4)与碱发生反应一般生成,反应过程中伴随热量的释放。如。(5)与某些盐反应一般生成。如实验室制取CO2的反应原理:。常见的碱(高频考点)1.氢氧化钠和氢氧化钙的比较2.碱的化学性质(碱4条)(1)与指示剂作用:碱溶液能使紫色石蕊试液变,使无色酚酞试液变。(2)与某些非金属氧化物等反应生成(详见实验突破)。如氢氧化钠必须密封保存的原因:;NaOH吸收工业尾气SO2:;检验CO2的原理:。中和反应(高频考点)1.定义:和作用生成与的反应叫做中和反应。2.实质:酸溶液中的离子和碱溶液中的离子结合成。3.应用:(1)改良土壤:如酸性土壤中可加入(填名称);(2)处理工厂废水:含有稀硫酸的废水可用来中和,反应的方程式是;(3)用于医药:中和胃酸可服用性药物;被蚊虫叮咬处有蚁酸(HCOOH),可涂一些物质(如)减轻痛痒。(一)氢氧化钠变质的探究1.氢氧化钠变质的原因:氢氧化钠与空气中的二氧化碳反应生成碳酸钠。反应的化学方程式:。2.检验NaOH是否变质的方法方法一:加入过量的稀盐酸有气泡产生,证明氢氧化钠已经变质。反应原理:。方法二:加入澄清石灰水有白色沉淀生成,证明氢氧化钠已经变质。反应原理:。方法三:加入氢氧化钡或氯化钙溶液有白色沉淀生成,证明氢氧化钠已经变质。反应原理:。3.探究氢氧化钠是部分变质还是全部变质的方案设计:(1)原理:取样品加水溶解;逐滴滴入氯化钡或氯化钙溶液至不再产生沉淀为止;滴入酚酞溶液后若溶液变红则部分变质,若溶液不变色说明全部变质。(2)分析:由于NaOH和生成的Na2CO3均能使酚酞溶液变色,所以不能直接加入指示剂进行鉴别;加入BaCl2或CaCl2反应的化学方程式为:;反应后的物质为NaCl和CaCO3沉淀或NaCl和BaCO3沉淀,溶液呈中性,滴加酚酞溶液变红,则说明原溶液中含有碱性物质,利用该原理可以判断NaOH是否完全变质。【温馨提示】不能加Ca(OH)2或Ba(OH)2与Na2CO3反应,若加入Ca(OH)2或Ba(OH)2,会引入新杂质OH-,导致不能判断原溶液中是否含有NaOH。4.总结提高:氢氧化钠变质是由于它与空气中的二氧化碳发生反应的缘故,因此氢氧化钠应保存。(二)氢氧化钙变质的探究变质反应的化学方程式:。1.氢氧化钙变质的原因:氢氧化钙与空气中的二氧化碳反应生成碳酸钙。2.检验氢氧化钙是否变质的方法:加入盐酸,有气泡产生说明氢氧化钙已变质。3.探究氢氧化钙是部分变质还是全部变质的方案设计:取少量样品于烧杯中,加入适量水,充分搅拌,过滤,取少量滤液于试管中,通入二氧化碳,有白色沉淀产生,氢氧化钙未完全变质,若无白色沉淀生成则全部变质。4.总结提高:氢氧化钙变质是由于它与空气中的二氧化碳发生反应的缘故,因此氢氧化

夏萍****文章
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















