


如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
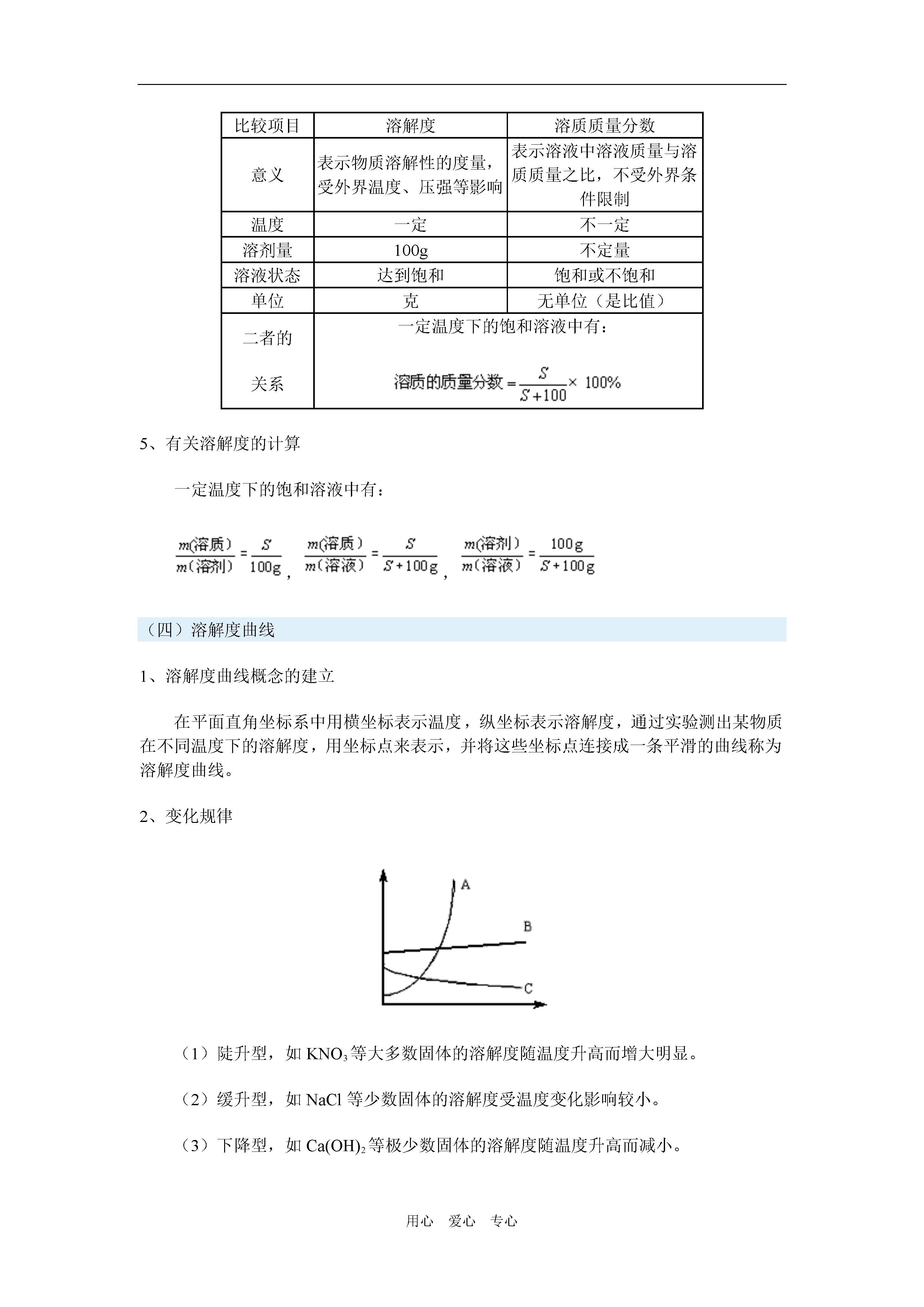
用心爱心专心溶解度一周强化一、一周内容概述(一)饱和溶液不饱和溶液饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时所得到的溶液,叫做这种溶质的饱和溶液。不饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质还能继续溶解时所得到的溶液,叫做这种溶质的不饱和溶液。1、明确条件:一定温度和一定量溶剂,这两个条件缺一不可,如室温时,100g水中溶解31.6g硝酸钾达到饱和,若升高温度或增加溶剂的质量,原来饱和的硝酸钾溶液就变成不饱和溶液。2、理解标准(1)不能再溶解某种溶质是指在该条件下,一定量溶剂里溶解该物质的量达到了最大限度。如果恰好为最大量时,底部不会有固体析出;如果超过最大量时,多余的固体会析出;(2)不饱和溶液中的“能”指在一定温度下,一定量溶剂里,溶解该物质的量还没有达到最大限度.3、判断溶液是否饱和的依据:(1)看一定温度下,有没有不能继续溶解的剩余溶质存在。如果有且溶质的量不再减少,则该溶液是这种溶质的饱和溶液。(2)在一定温度下,有溶质析出的剩余溶液一定是该溶质的饱和溶液。(3)在一定温度下的溶液中,若既没有未溶解的固体也没有析出的固体,可向溶液中再加入少量原溶质,若不能溶解表明原溶液是该溶质的饱和溶液,反之,是该溶质的不饱和溶液。(二)饱和溶液与不饱和溶液的转化大多数情况下,饱和溶液和不饱和溶液存在以下转化关系(溶质为固体):1、此转化方法适用于大多数固体物质,因为大多数固体物质在溶剂中溶解的最大质量是随着温度的升高而增大,随溶剂质量的增加而增大,反之亦然。2、极少数固体物质、如熟石灰[Ca(OH)2],在一定量的水中溶解的最大质量是随着温度的升高而降低的。因此熟石灰的饱和溶液与不饱和溶液的相互转化条件为:(三)溶解度1、溶解性一种物质溶解在另一种物质里的能力称为溶解性。溶解性是定性的表示物质溶解能力的大小,常用易溶、可溶、微溶、难溶来表示。2、固体物质的溶解度(1)定义:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。溶解度是用具体的数值定量的表示物质在一定温度下,在100g溶剂中的最大溶解能力。(2)含义:已知某物质在一定温度下的溶解度,其涵义是指该物质在此温度下,在100g溶剂里达到饱和状态时所溶解的质量。例如,NaCl在20℃时的溶解度为36.0g,就是指20℃时,100g水中溶解NaCl达到饱和时的质量为36.0g。(3)影响因素:3、固体物质的溶解度(S)与溶解性的关系4、溶质的质量分数与溶解度的关系比较项目溶解度溶质质量分数意义表示物质溶解性的度量,受外界温度、压强等影响表示溶液中溶液质量与溶质质量之比,不受外界条件限制温度一定不一定溶剂量100g不定量溶液状态达到饱和饱和或不饱和单位克无单位(是比值)二者的关系一定温度下的饱和溶液中有:5、有关溶解度的计算一定温度下的饱和溶液中有:,,(四)溶解度曲线1、溶解度曲线概念的建立在平面直角坐标系中用横坐标表示温度,纵坐标表示溶解度,通过实验测出某物质在不同温度下的溶解度,用坐标点来表示,并将这些坐标点连接成一条平滑的曲线称为溶解度曲线。2、变化规律(1)陡升型,如KNO3等大多数固体的溶解度随温度升高而增大明显。(2)缓升型,如NaCl等少数固体的溶解度受温度变化影响较小。(3)下降型,如Ca(OH)2等极少数固体的溶解度随温度升高而减小。二、重难点知识讲解(一)固体溶解度概念的理解关键抓住四个要点:1、条件:在一定温度下。因为物质的溶解度会随温度的变化而变化,故不指明温度时,溶解度没有意义。2、标准:在100g溶剂中。物质溶解量的多少与溶剂量的多少成正比,要比较物质溶解性的大小,必须要等量溶剂,这样标准才统一。注意这里100g是溶剂的质量,不能误以为是溶液的质量。3、状态:达到饱和时。只有在一定量的溶剂(100g)中达到饱和(溶解达到最大限度)时,溶质的量才是一个确定的值。4、单位:克。[严格地说应该是g/100g(溶剂)]。(二)溶解度曲线的意义及应用

小宏****aa
 实名认证
实名认证
 内容提供者
内容提供者
最近下载


















