


如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
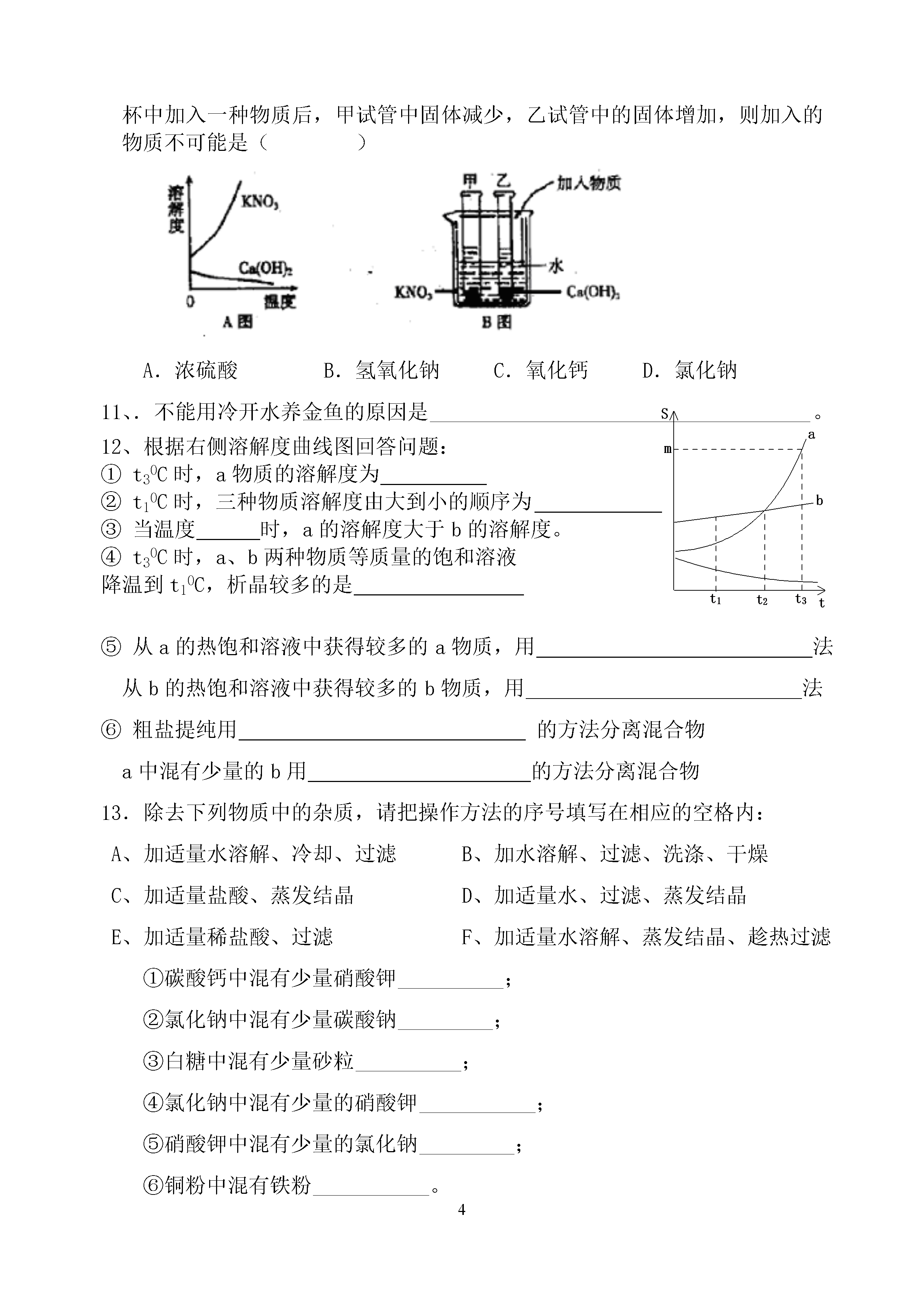
4基本概念4《溶液》一、溶液的形成1、溶液(1)溶液的概念:一种或几种物质分散到另一种物质里形成的、、,叫做溶液(2)溶液的基本特征:、、。注意:a、溶液不一定无色,如CuSO4为蓝色FeSO4为浅绿色Fe2(SO4)3为黄色b、溶质可以是固体、液体或气体;水是最常用的溶剂c、溶液的质量=的质量+的质量溶液的体积≠溶质的体积+溶剂的体积d、溶液的名称:溶质的溶剂溶液(如:碘酒——碘的酒精溶液)固体、气体溶于液体,液体为溶剂2、溶质和溶剂的判断有水,水为溶剂液体溶于液体,3、饱和溶液、不饱和溶液无水,量多的为溶剂(1)概念:(2)判断方法:看有无不溶物或继续加入该溶质,看能否溶解不饱和溶液饱和溶液降温、蒸发溶剂、加溶质升温、加溶剂(3)饱和溶液和不饱和溶液之间的转化注:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低②最可靠的方法是:加、。(4)浓、稀溶液与饱和、不饱和溶液之间的关系①饱和溶液不一定是浓溶液②不饱和溶液不一定是稀溶液,如饱和的石灰水溶液就是稀溶液③在一定温度时,同一种溶质的饱和溶液一定要比它的不饱和溶液浓(5)溶解时放热、吸热现象溶解吸热:如3溶解溶解放热:如溶解、溶解溶解没有明显热现象:如二、溶解度1、固体的溶解度(1)溶解度定义:。四要素:①条件:②标准:溶剂③状态:④质量:单位:(2)溶解度的含义:20℃时NaCl的溶液度为36g含义:(3)影响固体溶解度的因素:①溶质、溶剂的性质(种类)大多数固体物的溶解度随温度升高而升高;如KNO3②温度少数固体物质的溶解度受温度的影响很小;如NaCl极少数物质溶解度随温度升高而降低。如Ca(OH)2(4)溶解度曲线800t1t2t3NtSP·A例:(1)t3℃时A的溶解度为B·(2)P点的的含义C(3)N点为可通过的方法使它变为饱和。(4)t1℃时A、B、C、溶解度由大到小的顺序(5)从A溶液中获取A晶体可用的方法获取晶体。(6)从B的溶液中获取晶体,适宜采用的方法获取晶体。(7)t2℃时A、B、C的饱和溶液各W克,降温到t1℃会析出晶体的有无晶体析出的有,所得溶液中溶质的质量分数由小到大依次为(8)除去A中的泥沙用法;分离A与B(含量少)的混合物,用法。2、气体的溶解度(1)气体溶解度的定义:在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。(2)影响因素:①气体的性质②温度(温度越高,气体溶解度越小)③压强(压强越大,气体溶解度越大)3、混合物的分离(1)过滤法:分离可溶物+难溶物(2)结晶法:分离几种可溶性物质结晶的两种方法蒸发溶剂,如NaCl(海水晒盐)降低温度(冷却热的饱和溶液,如KNO3)三、溶质的质量分数1、公式:溶质质量分数=×100%S100+S2、在饱和溶液中:溶质质量分数C%=×100%(C<S)3、配制一定溶质质量分数的溶液(1)用固体配制:①步骤:、、②仪器:、、、、、(2)用浓溶液稀释(稀释前后,溶质的质量不变)①步骤:、、②仪器:、、、。练习:1.下列适量物质溶于水后,可以造成溶液温度显著降低的是()A.硝酸铵B.蔗糖C.氯化钠D.浓硫酸2.2004年底,东南亚地区发生了罕见的海啸灾害,为防止疾病传染,需对河水处理后方可饮用。常用的措施有:①加热煮沸②消毒③净水④自然沉降,较合理的顺序为()A.③①②④B.④①③②C.④③②①D.③①④②3.以下饮料和食品中,属于溶液的是()A、豆浆B、牛奶C、矿泉水D、果酱4、人们在高山上煮鸡蛋时,常在水中加一些食盐以使鸡蛋快些煮熟,这是由于固体溶于水,往往使溶液()A.密度变大B.、凝固点下降C.沸点升高D.沸点降低5、右图是采用膜分离技术的海水淡化装置。对海水加压后,只有水分子可以通过淡化膜,离子等其他粒子不能通过淡化膜。加压前后,装置右侧海水增加的是()A.溶质质量分数B.溶剂质量C.溶液质量D.溶质质量6.下列说法正确的是()A、水是常用的溶剂,但溶剂并不都是水B、溶液都是由一种溶质和一种溶剂组成的C、溶质可以是固体、液体或气体,溶剂只能是液体D、食盐和蔗糖在溶液里都是以分子均匀分散的7.食盐在20℃时的溶解度是36克,在这个温度下,不可能得到的溶液的质量分数是()A、25%B、20%C、30%D、26.5%8.降低温度时,饱和溶液析出无水晶体后,不改变的是()A、溶液的质量B、溶解度C、溶质的质量分数D、溶剂的质量9.利用浓硫酸配制一定量的质量分数为20%的稀硫酸,正确的操作步骤是()A、计算—称量—溶
Ta的资源

2025年黑龙江省七台河市勃利县七年级数学上学期期末调研模拟试题含解析

2025年辽宁省大连市中学山区七年级数学第一学期期中学业水平测试模拟试题含解析

2025年莆田市重点中学七年级数学第一学期期中质量检测模拟试题含解析

2025年铜陵市数学七上期末综合测试试题含解析

2025年铜陵市数学七上期末预测试题含解析

2025年重庆两江新区七年级数学第一学期期中统考模拟试题含解析

2025年贵州省桐梓县联考七年级上学期1月期末数学质量检测试题含解析

2025年甘肃省张掖市临泽二中学、三中学、四中学七年级上学期1月期末数学预测试题含解析

2025年湖南省永州零冷两区七校联考数学七上期末预测试题含解析

2025年河南省柘城县张桥乡联合中学七年级数学第一学期期中联考模拟试题含解析

一条****贺6
 实名认证
实名认证
 内容提供者
内容提供者
最近下载
最新上传
商务英语BEC考试高级阅读真题.docx
妈妈的礼物作文用户编辑原创.docx
商务英语BEC考试阅读辅导素材.docx
商务英语BEC考试网上报名流程.docx
2025年黑龙江省七台河市勃利县数学七上期末达标测试试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末综合测试试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末质量跟踪监视模拟试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末联考试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末检测模拟试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末经典试题含解析.docx








