如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
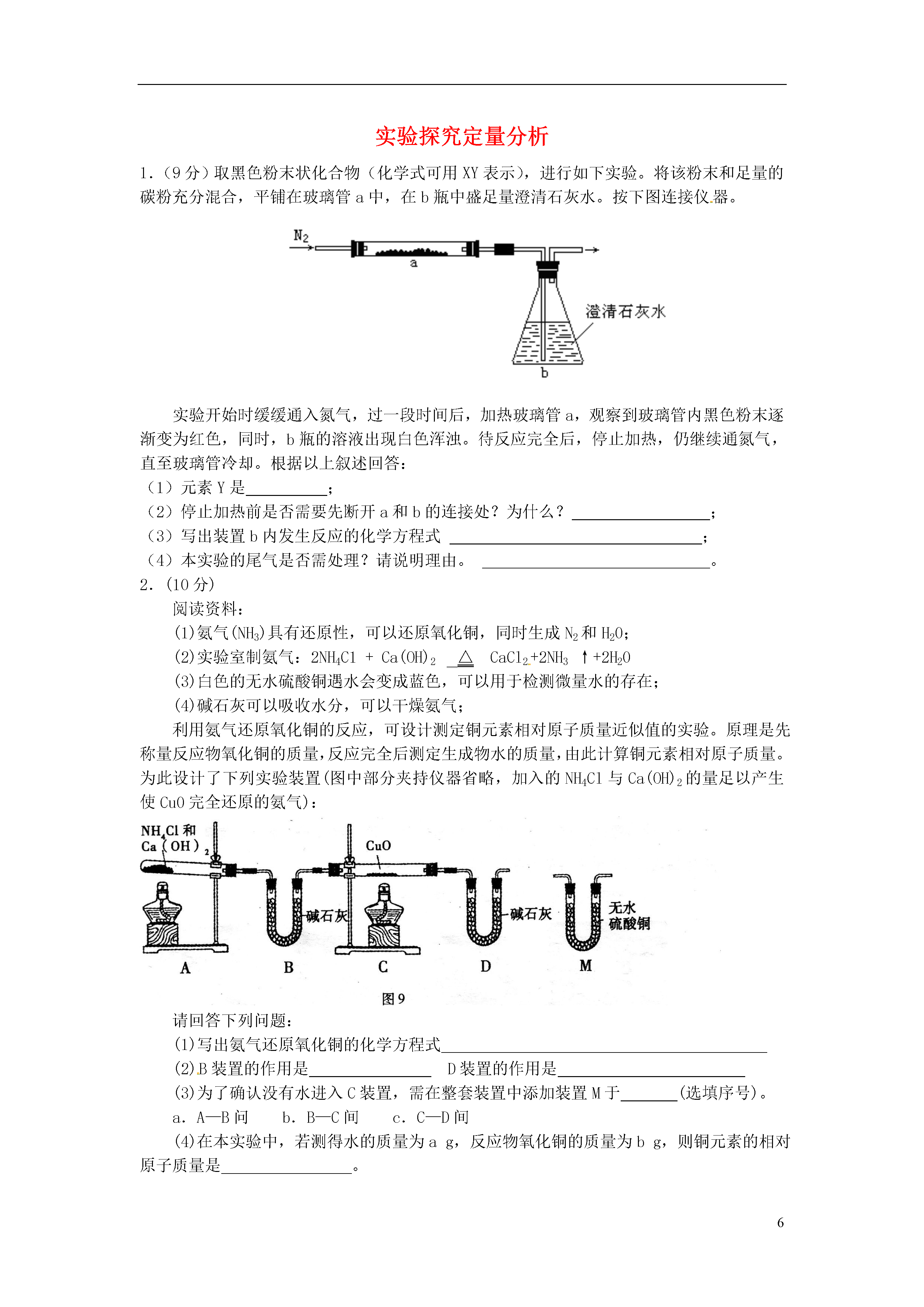
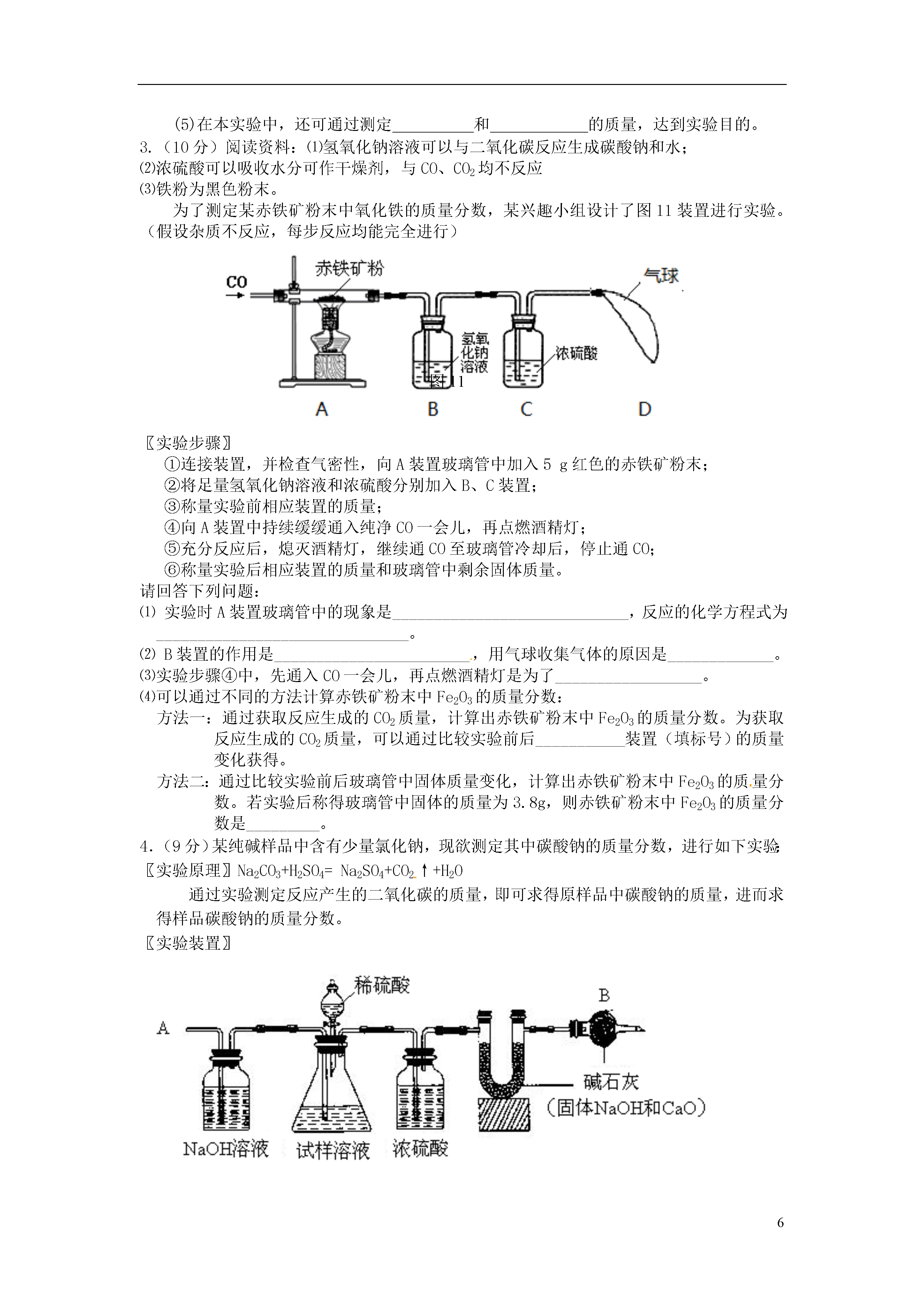
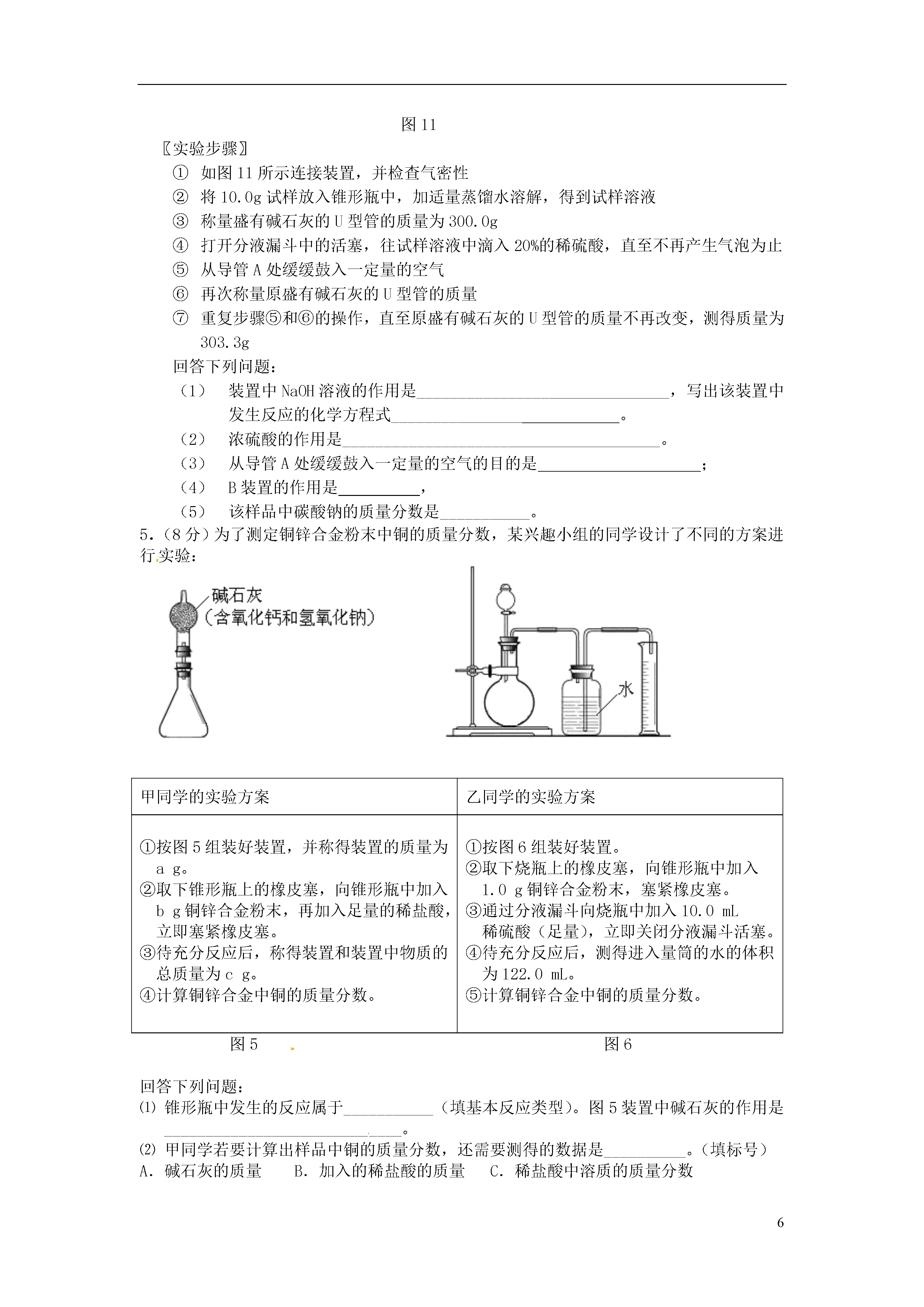
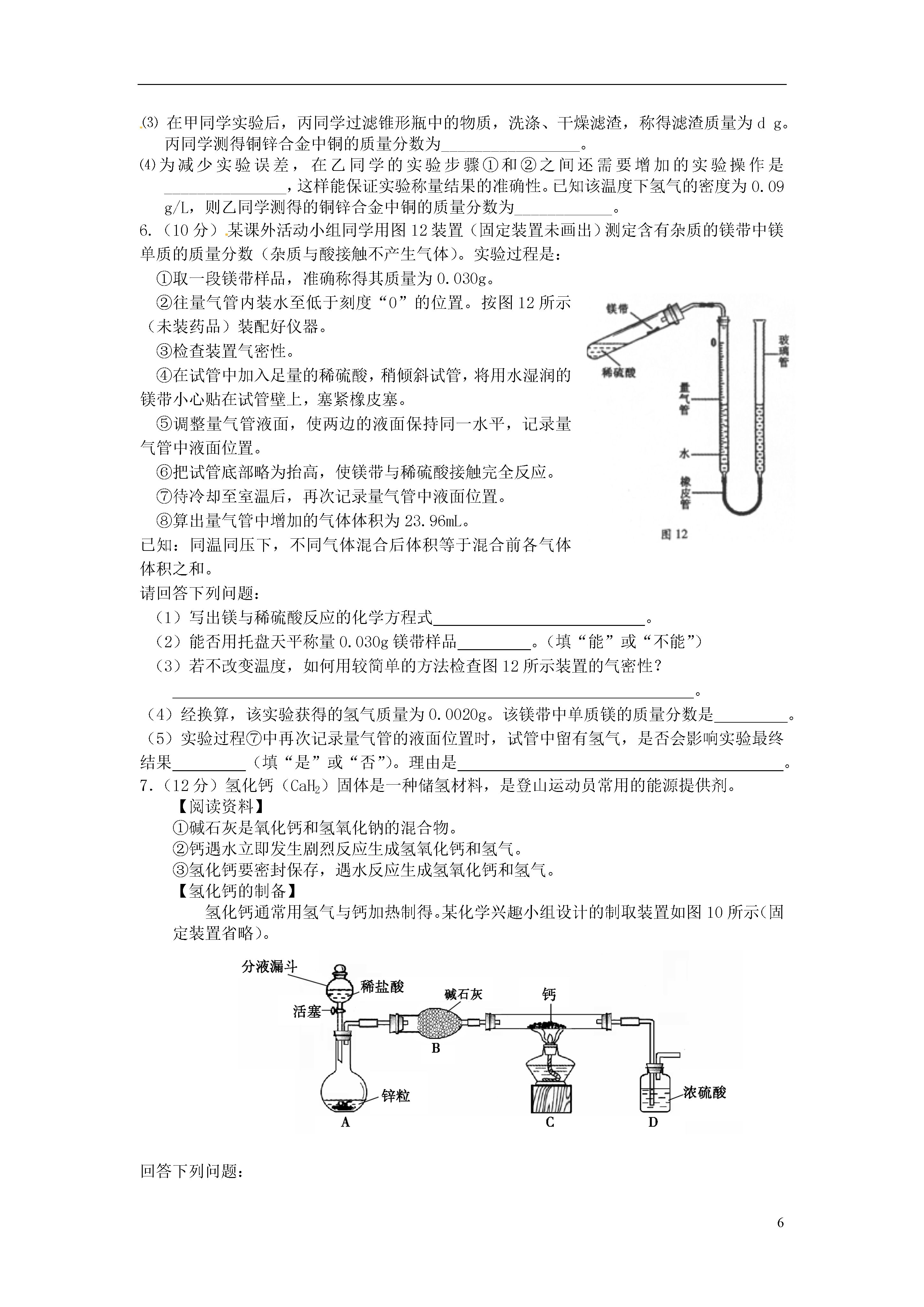
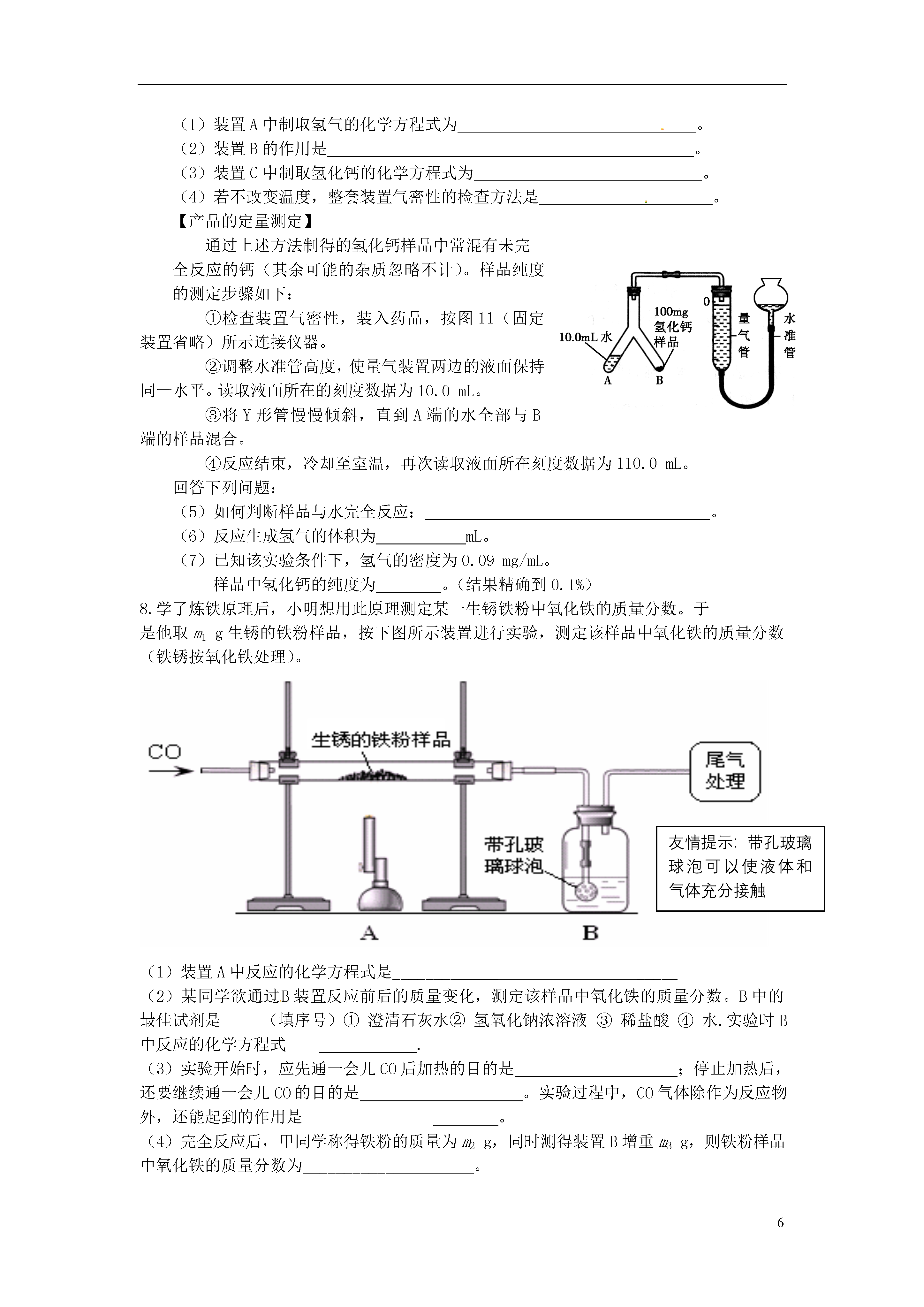
6实验探究定量分析1.(9分)取黑色粉末状化合物(化学式可用XY表示),进行如下实验。将该粉末和足量的碳粉充分混合,平铺在玻璃管a中,在b瓶中盛足量澄清石灰水。按下图连接仪器。实验开始时缓缓通入氮气,过一段时间后,加热玻璃管a,观察到玻璃管内黑色粉末逐渐变为红色,同时,b瓶的溶液出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至玻璃管冷却。根据以上叙述回答:(1)元素Y是;(2)停止加热前是否需要先断开a和b的连接处?为什么?;(3)写出装置b内发生反应的化学方程式;(4)本实验的尾气是否需处理?请说明理由。。2.(10分)阅读资料:(1)氨气(NH3)具有还原性,可以还原氧化铜,同时生成N2和H20;(2)实验室制氨气:2NH4C1+Ca(OH)2△CaCl2+2NH3↑+2H20(3)白色的无水硫酸铜遇水会变成蓝色,可以用于检测微量水的存在;(4)碱石灰可以吸收水分,可以干燥氨气;利用氨气还原氧化铜的反应,可设计测定铜元素相对原子质量近似值的实验。原理是先称量反应物氧化铜的质量,反应完全后测定生成物水的质量,由此计算铜元素相对原子质量。为此设计了下列实验装置(图中部分夹持仪器省略,加入的NH4Cl与Ca(OH)2的量足以产生使Cu0完全还原的氨气):请回答下列问题:(1)写出氨气还原氧化铜的化学方程式(2)B装置的作用是D装置的作用是(3)为了确认没有水进入C装置,需在整套装置中添加装置M于(选填序号)。a.A—B问b.B—C间c.C—D间(4)在本实验中,若测得水的质量为ag,反应物氧化铜的质量为bg,则铜元素的相对原子质量是。(5)在本实验中,还可通过测定和的质量,达到实验目的。3.(10分)阅读资料:⑴氢氧化钠溶液可以与二氧化碳反应生成碳酸钠和水;⑵浓硫酸可以吸收水分可作干燥剂,与CO、CO2均不反应⑶铁粉为黑色粉末。为了测定某赤铁矿粉末中氧化铁的质量分数,某兴趣小组设计了图11装置进行实验。(假设杂质不反应,每步反应均能完全进行)图11图11〖实验步骤〗①连接装置,并检查气密性,向A装置玻璃管中加入5g红色的赤铁矿粉末;②将足量氢氧化钠溶液和浓硫酸分别加入B、C装置;③称量实验前相应装置的质量;④向A装置中持续缓缓通入纯净CO一会儿,再点燃酒精灯;⑤充分反应后,熄灭酒精灯,继续通CO至玻璃管冷却后,停止通CO;⑥称量实验后相应装置的质量和玻璃管中剩余固体质量。请回答下列问题:⑴实验时A装置玻璃管中的现象是_____________________________,反应的化学方程式为_______________________________。⑵B装置的作用是________________________,用气球收集气体的原因是_____________。⑶实验步骤④中,先通入CO一会儿,再点燃酒精灯是为了__________________。⑷可以通过不同的方法计算赤铁矿粉末中Fe2O3的质量分数:方法一:通过获取反应生成的CO2质量,计算出赤铁矿粉末中Fe2O3的质量分数。为获取反应生成的CO2质量,可以通过比较实验前后___________装置(填标号)的质量变化获得。方法二:通过比较实验前后玻璃管中固体质量变化,计算出赤铁矿粉末中Fe2O3的质量分数。若实验后称得玻璃管中固体的质量为3.8g,则赤铁矿粉末中Fe2O3的质量分数是_________。4.(9分)某纯碱样品中含有少量氯化钠,现欲测定其中碳酸钠的质量分数,进行如下实验:〖实验原理〗Na2CO3+H2SO4=Na2SO4+CO2↑+H2O通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得样品碳酸钠的质量分数。〖实验装置〗图11〖实验步骤〗如图11所示连接装置,并检查气密性将10.0g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液称量盛有碱石灰的U型管的质量为300.0g打开分液漏斗中的活塞,往试样溶液中滴入20%的稀硫酸,直至不再产生气泡为止从导管A处缓缓鼓入一定量的空气再次称量原盛有碱石灰的U型管的质量重复步骤⑤和⑥的操作,直至原盛有碱石灰的U型管的质量不再改变,测得质量为303.3g回答下列问题:装置中NaOH溶液的作用是_______________________________,写出该装置中发生反应的化学方程式________________。浓硫酸的作用是_______________________________________。从导管A处缓缓鼓入一定量的空气的目的是;B装置的作用是,该样品中碳酸钠的质量分数是________
Ta的资源

2025年黑龙江大庆市三站中学数学七上期末统考试题含解析

2025年黑龙江大庆市三站中学七年级数学上学期期末综合测试模拟试题含解析

2025年辽宁省盘锦双台子区六校联考七年级数学上学期期末预测试题含解析

2025年贵州省凯里市华鑫实验学校七年级上学期1月期末数学预测试题含解析

2025年贵州省桐梓县联考数学七上期末复习检测试题含解析

2025年贵州省桐梓县联考七年级上学期1月期末数学经典模拟试题含解析

2025年贵州省桐梓县联考七年级数学上学期期末检测试题含解析

2025年湖南省怀化市七年级数学上学期期末教学质量检测模拟试题含解析

2025年湖北省黄冈市浠水县数学七上期末经典试题含解析

2025年湖北省武汉市汉阳区七年级数学上学期期末质量检测模拟试题含解析

努力****恨风
 实名认证
实名认证
 内容提供者
内容提供者
最近下载
最新上传
商务英语BEC考试高级阅读真题.docx
妈妈的礼物作文用户编辑原创.docx
商务英语BEC考试阅读辅导素材.docx
商务英语BEC考试网上报名流程.docx
2025年黑龙江省七台河市勃利县数学七上期末达标测试试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末综合测试试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末质量跟踪监视模拟试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末联考试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末检测模拟试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末经典试题含解析.docx








