



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
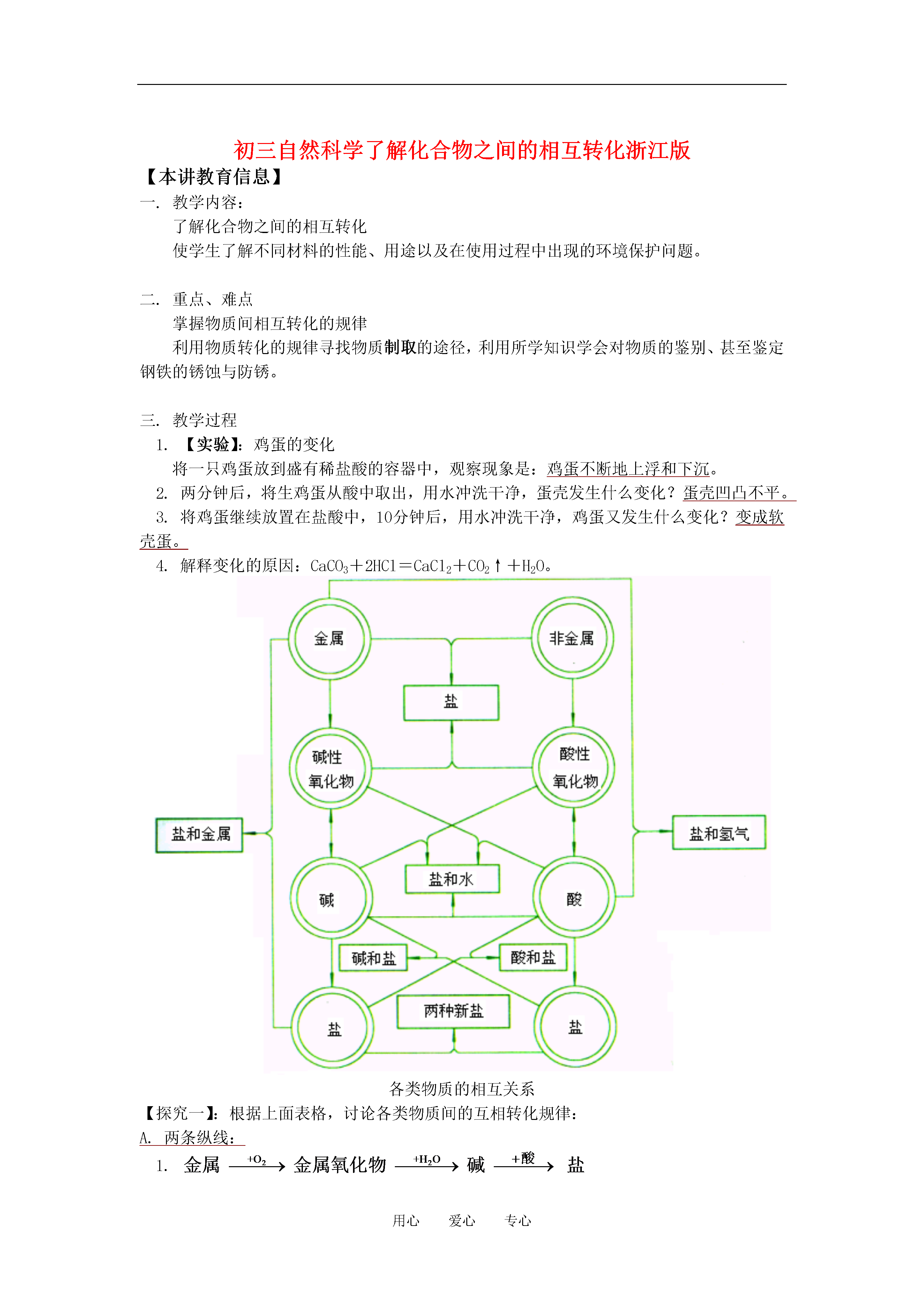
用心爱心专心初三自然科学了解化合物之间的相互转化浙江版【本讲教育信息】一.教学内容:了解化合物之间的相互转化使学生了解不同材料的性能、用途以及在使用过程中出现的环境保护问题。二.重点、难点掌握物质间相互转化的规律利用物质转化的规律寻找物质制取的途径,利用所学知识学会对物质的鉴别、甚至鉴定钢铁的锈蚀与防锈。三.教学过程1.【实验】:鸡蛋的变化将一只鸡蛋放到盛有稀盐酸的容器中,观察现象是:鸡蛋不断地上浮和下沉。2.两分钟后,将生鸡蛋从酸中取出,用水冲洗干净,蛋壳发生什么变化?蛋壳凹凸不平。3.将鸡蛋继续放置在盐酸中,10分钟后,用水冲洗干净,鸡蛋又发生什么变化?变成软壳蛋。4.解释变化的原因:CaCO3+2HCl=CaCl2+CO2↑+H2O。各类物质的相互关系【探究一】:根据上面表格,讨论各类物质间的互相转化规律:A.两条纵线:1.2.B.四条横线:金属+非金属→无氧酸盐2Fe+3Cl2=2FeCl3金属氧化物+非金属氧化物→含氧酸盐CaO+SiO2=CaSiO3酸+碱→盐+H2OHCl+NaOH=NaCl+H2O盐+盐→新盐+新盐AgNO3+NaCl=NaNO3+AgCl↓C.两条交叉线:1.金属氧化物+酸→盐+H2OFe2O3+6HCl=2FeCl3+3H2O2.非金属氧化物+碱→盐+H2OSO2+2NaOH=2Na2SO3+H2OD.两条弯线:1.金属+盐→新金属+盐Fe+CuSO4=Cu+FeSO42.金属+酸→盐+H2Zn+H2SO4=ZnSO4+H2↑【探究二】:根据上面表格,查找各类物质主要的化学性质:如:酸的性质交叉线:酸+金属氧化物→盐+H2O横线:酸+碱→盐+H2O弯线:酸+金属→盐+H2竖线:酸+盐→新酸+新盐【探究三】:根据上面表格,查找制取各类物质的可能途径:如:制取盐的可能途径:(8条)1.金属+非金属→无氧酸盐2.金属氧化物+非金属氧化物→含氧酸盐3.酸+碱→盐+H2O4.盐+盐→新盐+新盐5.金属氧化物+酸→盐+H2O6.非金属氧化物+碱→盐+H2O7.金属+盐→新金属+盐8.金属+酸→盐+H2总结①、沉淀的颜色颜色沉淀溶不溶于稀硝酸或盐酸AgCl、BaSO4CaCO3、BaCO3Mg(OH)2、Al(OH)3Fe(OH)3Cu(OH)2总结②、固体的颜色颜色固体物质NaOH、Ca(OH)2、CaCO3、无水CuSO4、NaCl、Na2CO3、CaO等Cu、Fe2O3炭粉(C)、MnO2、Fe3O4、CuOCu2(OH)2CO3CuSO4•5H2OKMnO4总结③、溶液的颜色颜色溶液铜盐(Cu2+)溶液,如CuSO4溶液、CuCl2溶液铁盐(Fe3+)溶液,如Fe2(SO4)3溶液、FeCl3溶液亚铁盐(Fe2+)溶液,如FeSO4溶液、FeCl2溶液KMnO4溶液钠盐(Na+)、钾盐(K+)、钙盐(Ca2+)、钡盐(Ba2+)等溶液总结④、离子的鉴别离子检验试剂H+OH-Cl-SO42-CO32-参考答案:所含离子H+OH-Cl-CO32-SO42-所用试剂紫色石蕊紫色石蕊或酚酞AgNO3溶液和稀HNO3酸或含Ca2+、Ba2+的溶液含Ba2+的溶液和稀硝酸现象变红使石蕊试液变蓝,酚酞变红生成白色沉淀不溶于稀HNO3加酸有气体生成;加含Ca2+、Ba2+的溶液生成白色沉淀生成白色沉淀不溶于稀HNO3[常见的材料](一)金属材料:合金――2种或2种以上的金属熔合在一起形成的混合物。(也可以是金属与非金属结合)铁的合金——钢钢:质坚硬,有弹性和延展性,机械性能好,可煅轧、压延、可铸造。可以分为两大类:碳素钢和合金钢。碳素钢:根据含碳量可分为低碳钢、中碳钢和高碳钢合金钢:根据所加的合金元素分。如不锈钢(含铬、镍元素)、锰钢、硅钢、钨钢等。铁还有另两种合金:生铁和熟铁。探究实验:探索铁生锈的条件?①提出问题:铁生锈的条件是什么?②设计方案——提供器材:带塞子的试管若干支,普通铁钉、蒸馏水、干燥剂③画出实验装置图(如下)提示:可以采用控制变量法,来探索决定的因素有哪些。介绍:若用一块纯铁片来进行上述实验,反而不宜发生锈蚀现象。④得出的结论:铁生锈,实际上是铁、氧气和水等物质相互作用,发生的一系列复杂的化学反应。铁锈的成分很复杂,主要是氧化铁。铁锈很疏松,易吸水。因此,铁制品表面的锈如不及时除去,会加快铁制品的生锈速度。金属的锈蚀既与周围环境中的水、空气有关,还与金属内部的结构有关。*防锈两大措施:①保护膜法如刷油漆、涂机油、封塑料膜、电镀②改变钢铁内部结构法如制成不锈钢*金属的回收和利用金
Ta的资源

2025年甘肃省武威市民勤县数学七上期末考试模拟试题含解析

2025年湖南省涟源市数学七上期末复习检测模拟试题含解析

2025年黑龙江大庆市三站中学数学七上期末经典模拟试题含解析

2025年黑龙江大庆市三站中学数学七上期末考试模拟试题含解析

2025年重庆市九龙坡区十校数学七上期末质量跟踪监视试题含解析

2025年辽宁省大连市中学山区七年级数学上学期期末复习检测模拟试题含解析

2025年湖南省怀化市七年级上学期1月期末数学综合测试模拟试题含解析

2025年湖南省涟源市七年级数学第一学期期中经典试题含解析

2025年湖北省襄阳市枣阳七年级数学第一学期期中达标测试试题含解析

2025年湖北省武汉市青山区七年级上学期1月期末数学考试试题含解析

淑然****by
 实名认证
实名认证
 内容提供者
内容提供者
最近下载
最新上传
商务英语BEC考试高级阅读真题.docx
妈妈的礼物作文用户编辑原创.docx
商务英语BEC考试阅读辅导素材.docx
商务英语BEC考试网上报名流程.docx
2025年黑龙江省七台河市勃利县数学七上期末达标测试试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末综合测试试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末质量跟踪监视模拟试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末联考试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末检测模拟试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末经典试题含解析.docx








