
如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
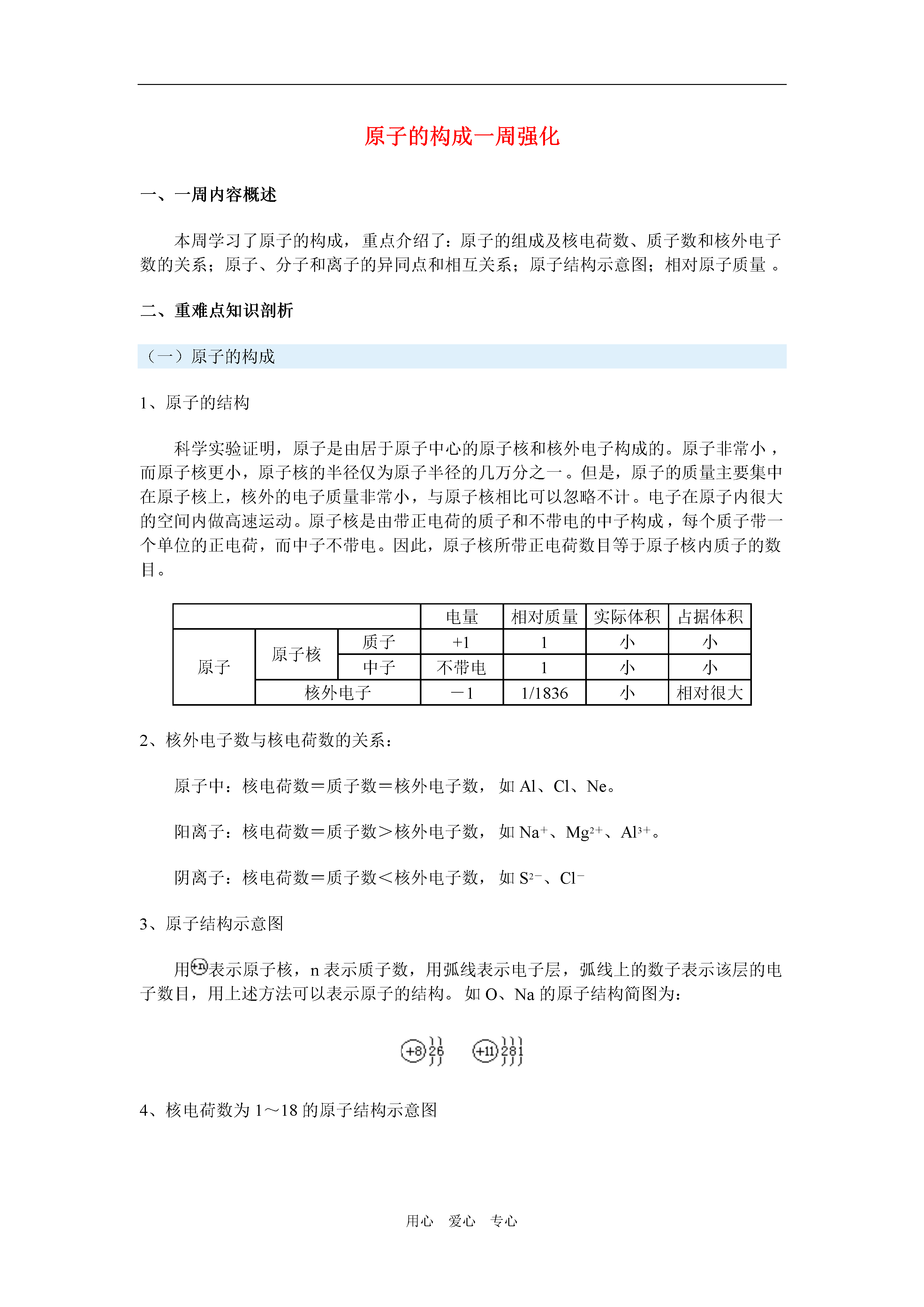
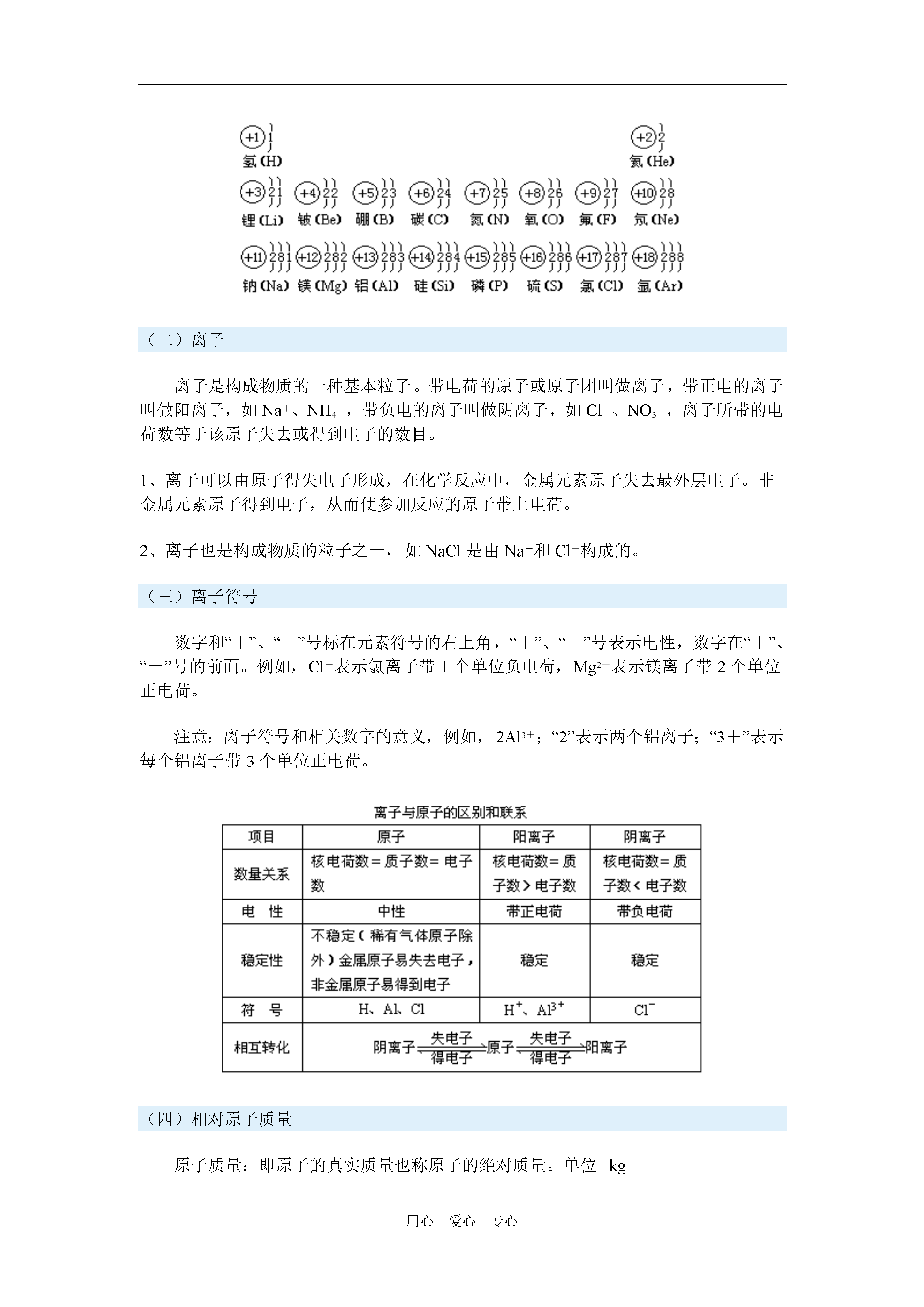
用心爱心专心原子的构成一周强化一、一周内容概述本周学习了原子的构成,重点介绍了:原子的组成及核电荷数、质子数和核外电子数的关系;原子、分子和离子的异同点和相互关系;原子结构示意图;相对原子质量。二、重难点知识剖析(一)原子的构成1、原子的结构科学实验证明,原子是由居于原子中心的原子核和核外电子构成的。原子非常小,而原子核更小,原子核的半径仅为原子半径的几万分之一。但是,原子的质量主要集中在原子核上,核外的电子质量非常小,与原子核相比可以忽略不计。电子在原子内很大的空间内做高速运动。原子核是由带正电荷的质子和不带电的中子构成,每个质子带一个单位的正电荷,而中子不带电。因此,原子核所带正电荷数目等于原子核内质子的数目。电量相对质量实际体积占据体积原子原子核质子+11小小中子不带电1小小核外电子-11/1836小相对很大2、核外电子数与核电荷数的关系:原子中:核电荷数=质子数=核外电子数,如Al、Cl、Ne。阳离子:核电荷数=质子数>核外电子数,如Na+、Mg2+、Al3+。阴离子:核电荷数=质子数<核外电子数,如S2-、Cl-3、原子结构示意图用表示原子核,n表示质子数,用弧线表示电子层,弧线上的数子表示该层的电子数目,用上述方法可以表示原子的结构。如O、Na的原子结构简图为:4、核电荷数为1~18的原子结构示意图(二)离子离子是构成物质的一种基本粒子。带电荷的原子或原子团叫做离子,带正电的离子叫做阳离子,如Na+、NH4+,带负电的离子叫做阴离子,如Cl-、NO3-,离子所带的电荷数等于该原子失去或得到电子的数目。1、离子可以由原子得失电子形成,在化学反应中,金属元素原子失去最外层电子。非金属元素原子得到电子,从而使参加反应的原子带上电荷。2、离子也是构成物质的粒子之一,如NaCl是由Na+和Cl-构成的。(三)离子符号数字和“+”、“-”号标在元素符号的右上角,“+”、“-”号表示电性,数字在“+”、“-”号的前面。例如,Cl-表示氯离子带1个单位负电荷,Mg2+表示镁离子带2个单位正电荷。注意:离子符号和相关数字的意义,例如,2Al3+;“2”表示两个铝离子;“3+”表示每个铝离子带3个单位正电荷。(四)相对原子质量原子质量:即原子的真实质量也称原子的绝对质量。单位kg相对原子质量:以一个碳-12原子的质量的1/12作为标准,其他原子的质量跟它比较所得的比值,称为这种原子的相对原子质量。注:①相对原子质量不是原子的真实质量,而是相对质量。②相对原子质量是一个比值,它的国际单位制(SI)单位为1(一般不写出)③质子、中子的相对质量约为1
Ta的资源

2024-2025学年内蒙古巴彦淖尔市第五中学数学七上期末统考试题含解析

2024-2025学年内蒙古呼伦贝尔市名校数学七上期末学业质量监测模拟试题含解析

2024-2025学年内蒙古乌兰察布市名校七年级数学第一学期期中经典试题含解析

2024-2025学年云南省红河州数学七上期末调研试题含解析

2024-2025学年云南省红河州七年级数学第一学期期中统考模拟试题含解析

2024-2025学年兰州市重点中学数学七上期末学业质量监测模拟试题含解析

2024-2025学年亳州市重点中学七年级数学上学期期末经典模拟试题含解析

2024-2025学年云南省曲靖市沾益县七年级数学上学期期末检测试题含解析

2024-2025学年云南省重点中学数学七上期末检测试题含解析

2024-2025学年云南省昭通市盐津县数学七上期末质量跟踪监视试题含解析

琰琬****买买
 实名认证
实名认证
 内容提供者
内容提供者
最近下载
最新上传
2024-2025学年内蒙古自治区呼伦贝尔市满洲里市七年级数学第一学期期中质量检测模拟试题含解析.docx
2024-2025学年内蒙古自治区呼伦贝尔市满洲里市七年级数学第一学期期中综合测试模拟试题含解析.docx
2024-2025学年内蒙古自治区呼伦贝尔市满洲里市七年级数学第一学期期中经典模拟试题含解析.docx
2024-2025学年内蒙古自治区呼伦贝尔市满洲里市七年级数学上学期期末预测试题含解析.docx
2024-2025学年内蒙古自治区呼伦贝尔市满洲里市七年级数学第一学期期中检测模拟试题含解析.docx
2024-2025学年内蒙古自治区呼伦贝尔市满洲里市七年级数学第一学期期中学业水平测试试题含解析.docx
2024-2025学年内蒙古自治区呼伦贝尔市满洲里市七年级数学上学期期末联考试题含解析.docx
2024-2025学年内蒙古自治区呼伦贝尔市满洲里市七年级数学上学期期末质量跟踪监视试题含解析.docx
2024-2025学年内蒙古自治区呼伦贝尔市满洲里市七年级数学上学期期末经典试题含解析.docx
2024-2025学年内蒙古自治区呼伦贝尔市满洲里市七年级数学上学期期末综合测试试题含解析.docx








