



如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
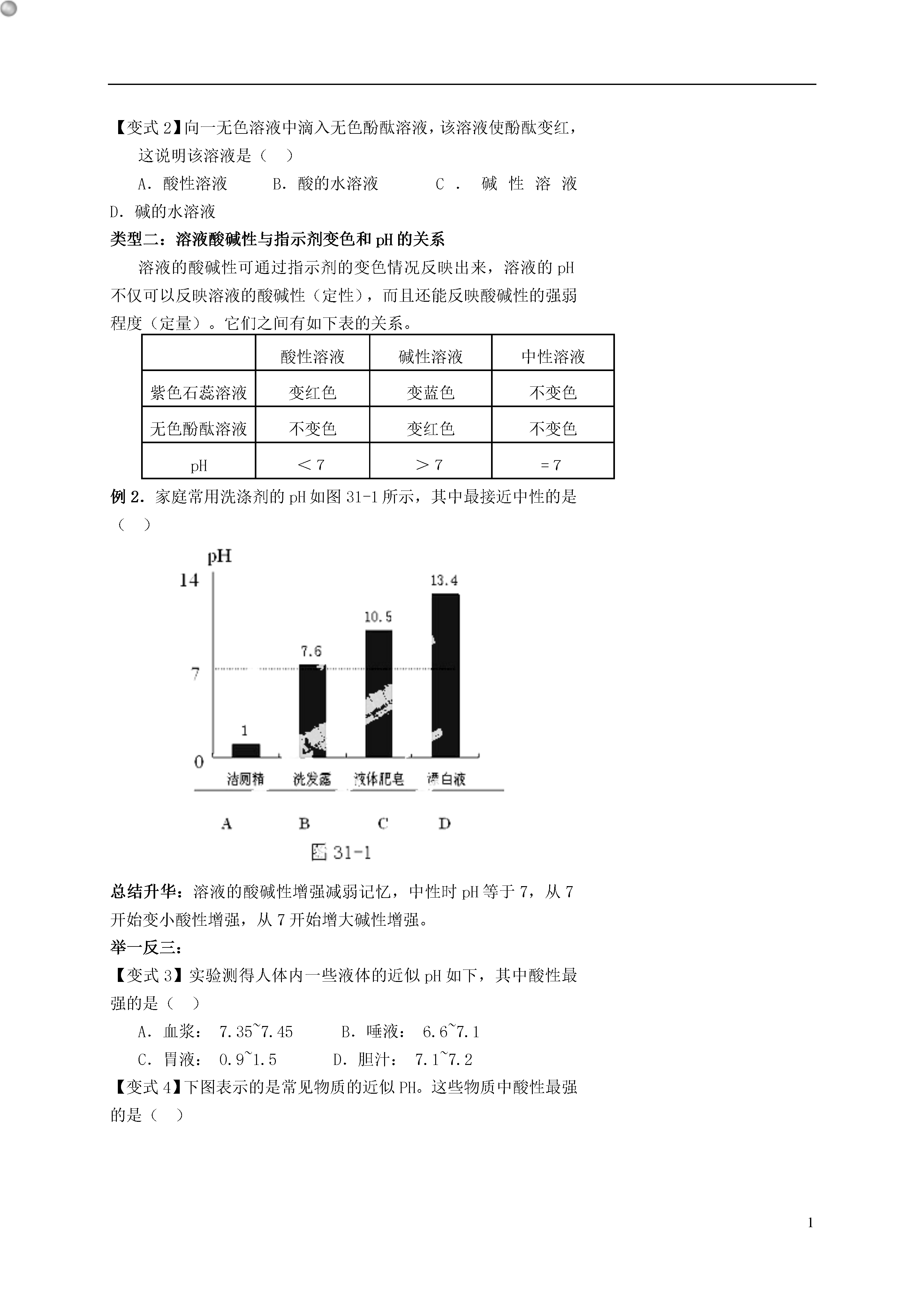
1酸碱盐一、目标与策略明确学习目标及主要的学习方法是提高学习效率的首要条件,要做到心中有数!学习目标:掌握常见的酸及其通性。掌握常见的碱及其通性。掌握生活中常见的盐及其化学性质。掌握与盐相关的化学实验。了解有关化肥的性质。重点难点:常见的酸及其通性。常见的碱及其通性。生活中常见的盐及其化学性质。与盐相关的化学实验。学习策略:酸碱盐及其化学性质是初中化学的重点,这一章的学习,记化学方程式是一个重要的环节,一定要把重点方程式会默写,在此基础上,酸碱盐相关化学性质也要理解、记住。二、学习与应用知识点一:酸知识点二:碱知识点三:溶液酸碱度的表示方法——pH生活中常见的盐类型一:酸与碱的鉴别溶液酸碱性的鉴别是根据酸溶液中含有H+,碱溶液中含有OH-,根据H+和OH-的性质不同,与其他物质反应的现象不同加以鉴别,最常用的物质是指示剂或pH试纸。例1.能将NaOH、Ca(OH)2、HCl三种溶液区分开的一种试剂是()A.酚酞溶液B.紫色石蕊溶液C.碳酸钠溶液D.氯化钠溶液总结升华:酸与碱的鉴别首先要考虑物质的类别,一般来讲酸溶液显酸性,碱溶液显碱性,盐溶液显中性。如果待鉴别物质分别属于不同的类别,就要考虑用指示剂。如果几种酸和碱的鉴别单凭指示剂就无法做到,这时就要考虑酸或碱中的酸根离子或金属阳离子的性质,进行鉴别。举一反三:【变式1】不能将NaCl、HCl、Ca(OH)2三种无色溶液一次性区别开的物质是()A.紫色石蕊试液B.酚酞试液C.碳酸钠溶液D.pH试纸【变式2】向一无色溶液中滴入无色酚酞溶液,该溶液使酚酞变红,这说明该溶液是()A.酸性溶液B.酸的水溶液C.碱性溶液D.碱的水溶液类型二:溶液酸碱性与指示剂变色和pH的关系溶液的酸碱性可通过指示剂的变色情况反映出来,溶液的pH不仅可以反映溶液的酸碱性(定性),而且还能反映酸碱性的强弱程度(定量)。它们之间有如下表的关系。酸性溶液碱性溶液中性溶液紫色石蕊溶液变红色变蓝色不变色无色酚酞溶液不变色变红色不变色pH<7>7=7例2.家庭常用洗涤剂的pH如图31-1所示,其中最接近中性的是()总结升华:溶液的酸碱性增强减弱记忆,中性时pH等于7,从7开始变小酸性增强,从7开始增大碱性增强。举一反三:【变式3】实验测得人体内一些液体的近似pH如下,其中酸性最强的是()A.血浆:7.35~7.45B.唾液:6.6~7.1C.胃液:0.9~1.5D.胆汁:7.1~7.2【变式4】下图表示的是常见物质的近似PH。这些物质中酸性最强的是()图32-2A.醋B.苹果汁C.西瓜汁D.肥皂水类型三:酸、碱的化学性质与用途酸、碱的化学性质比较零散,所以对于酸与碱化学性质的学习一是要掌握常见酸、碱的特性,如浓盐酸的挥发性、浓硫酸的吸水性,脱水性等;二是利用归纳法掌握酸和碱的通性。例3.下列物质放在敞口容器中一段时间后,质量明显减少的是()A.浓硫酸B.浓盐酸C.氢氧化钠D.氯化钠总结升华:盐酸与硫酸属于酸,具有酸的共性,但由于酸根离子不同,使它们都有其个性,如浓盐酸有挥发性,浓硫酸有吸水性。举一反三:【变式5】家用铝壶使用长时间后会在铝壶内壁产生水垢,已知水垢的主要成分是CaCO3和Mg(OH)2,可以用盐酸除去。但如果盐酸使用过量则会造成不良影响,请写出有关化学方程式。【变式6】某同学在化学晚会上表演如下魔术:用毛笔蘸取一种无色液体在一张白纸上书写了“化学魔术”四字,然后再喷上一种无色液体,白纸上立即出现了红色的“化学魔术”四字,该学生先后所用的无色液体可能是()A.石蕊溶液、稀硫酸B.酚酞溶液、“雪碧”饮料C.氢氧化钠溶液、酚酞溶液D.CuSO4溶液、NaOH溶液类型四:有关中和反应的应用中和反应是酸碱之间发生的重要的化学反应,中和反应的实质是H++OH-=H2O,从而使溶液的酸碱性发生改变,在农业、环保、医疗等方面有广泛的用途。其中中和反应实验的探究是中考的热点探究问题。☆例4.某校化学学习小组的同学做氢氧化钠溶液和稀硫酸的中和反应实验时,由于实验中忘记加酚酞溶液,不知二者是否恰好完全反应中和,因此他们对反应后溶液中的溶质是什么提出猜想,并展开探究。提出问题:溶液中的溶质可能是什么?猜想:他们的猜想(1)溶质是硫酸钠;你的猜想(2)溶质是________________;(3)溶质是________________。请选择你的其中一种猜想,设计实验加以证明。设计实验:猜想编号实验过程现象结论(或化学方程式)总结升华:化学反应的后的情况判断一般来讲有三种情况:一是两种反应物恰好完全反应,既两种反应物均无剩余,
Ta的资源

2025年重庆市九龙坡区十校七年级数学第一学期期中联考试题含解析

2025年重庆市九龙坡区十校七年级数学第一学期期中学业质量监测模拟试题含解析

2025年甘肃省武威市民勤县七年级数学上学期期末检测试题含解析

2025年重庆市九龙坡区十校七年级上学期1月期末数学联考试题含解析

2025年辽宁省大连市中学山区数学七上期末联考模拟试题含解析

2025年贵州省都匀市第六中学七年级上学期1月期末数学监测试题含解析

2025年贵州省都匀市第六中学七年级上学期1月期末数学预测试题含解析

2025年贵州省凯里市华鑫实验学校七年级数学上学期期末学业水平测试模拟试题含解析

2025年莆田市重点中学七年级数学第一学期期中质量跟踪监视模拟试题含解析

2025年甘肃省兰州市第九中学七年级上学期1月期末数学质量跟踪监视试题含解析

小云****66
 实名认证
实名认证
 内容提供者
内容提供者
最近下载
最新上传
商务英语BEC考试高级阅读真题.docx
妈妈的礼物作文用户编辑原创.docx
商务英语BEC考试阅读辅导素材.docx
商务英语BEC考试网上报名流程.docx
2025年黑龙江省七台河市勃利县数学七上期末达标测试试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末综合测试试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末质量跟踪监视模拟试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末联考试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末检测模拟试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末经典试题含解析.docx








