


如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
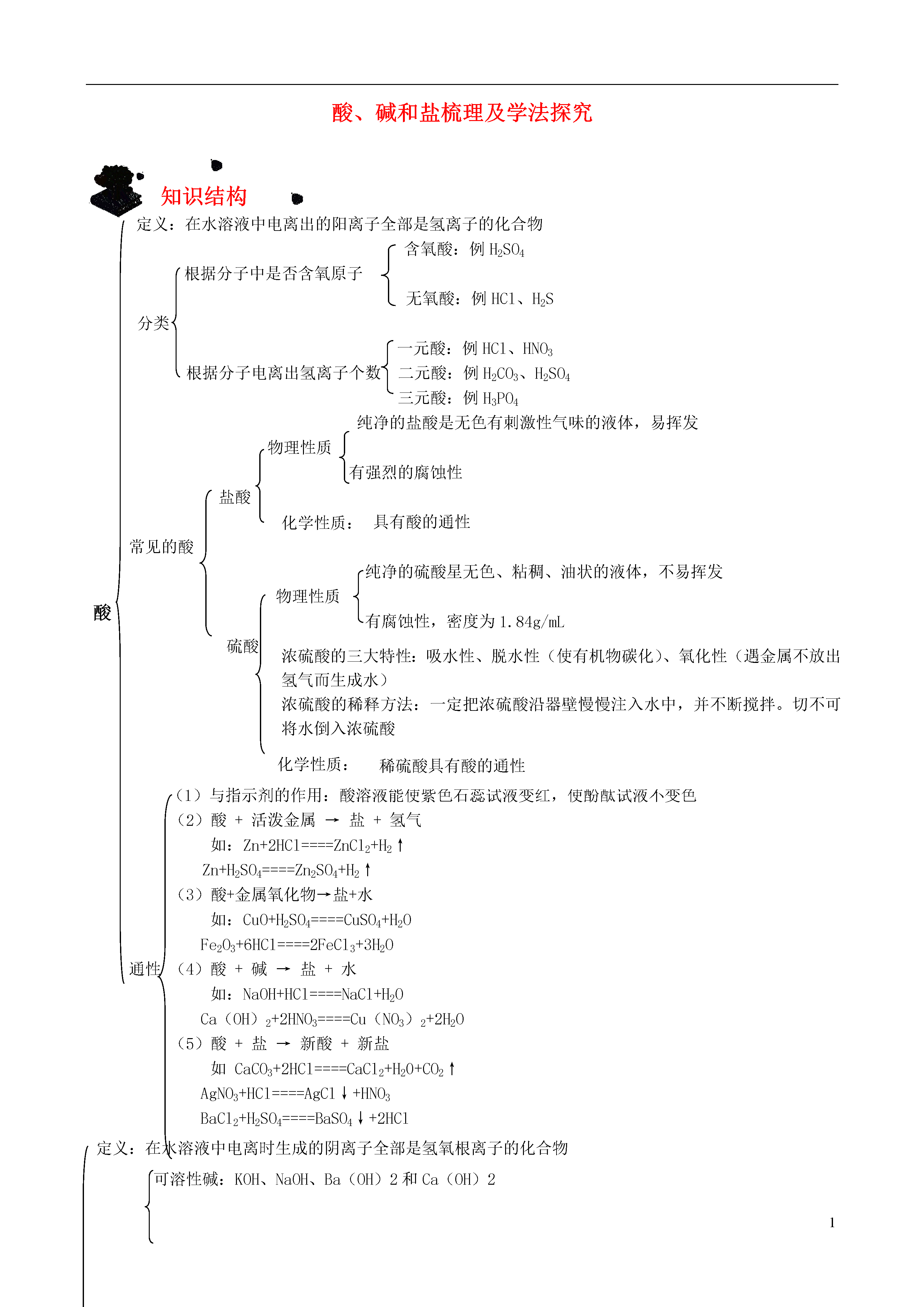
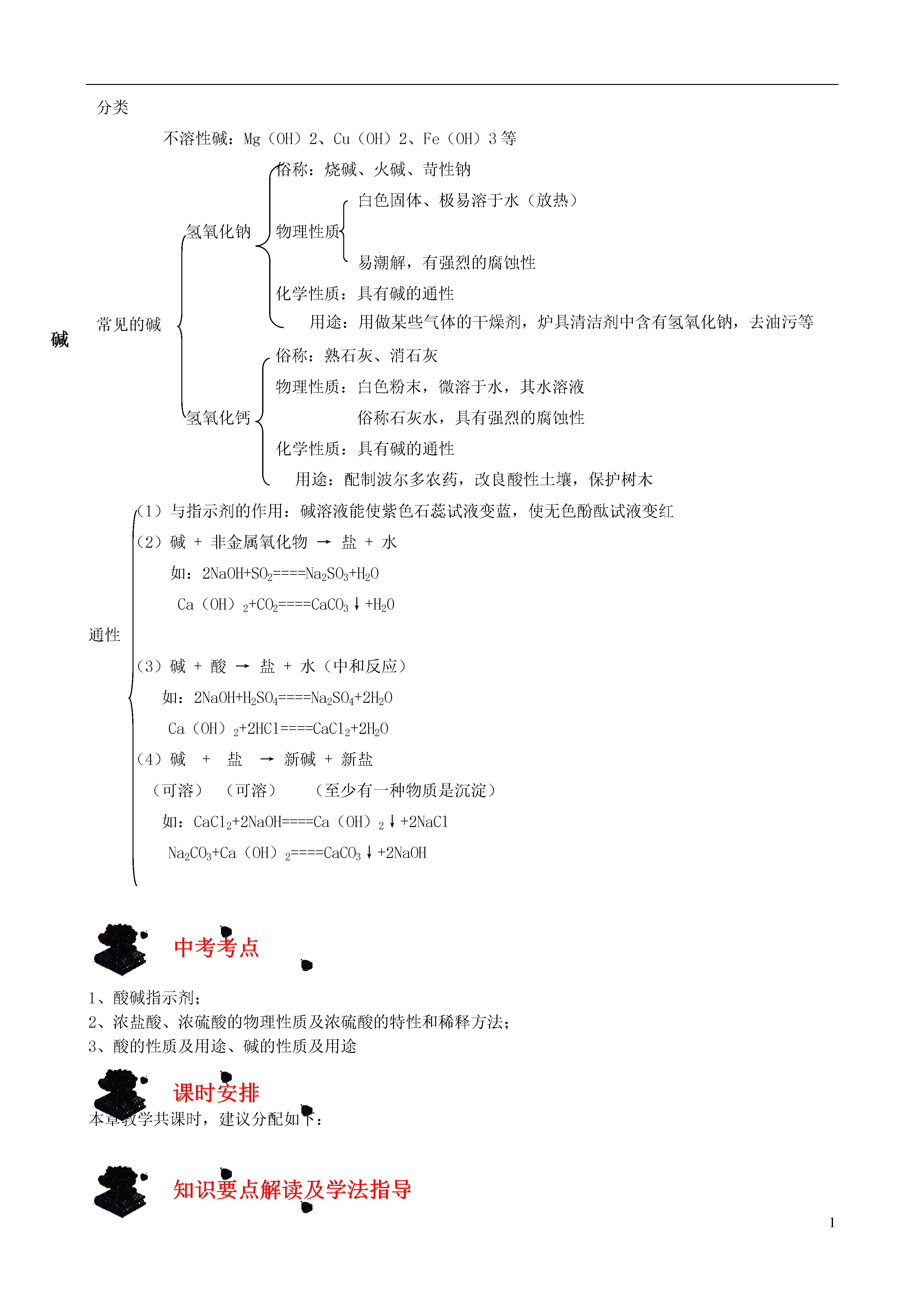
1酸、碱和盐梳理及学法探究知识结构定义:在水溶液中电离出的阳离子全部是氢离子的化合物含氧酸:例H2SO4根据分子中是否含氧原子无氧酸:例HCl、H2S分类一元酸:例HCl、HNO3根据分子电离出氢离子个数二元酸:例H2CO3、H2SO4三元酸:例H3PO4纯净的盐酸是无色有刺激性气味的液体,易挥发物理性质有强烈的腐蚀性化学性质:盐酸具有酸的通性常见的酸纯净的硫酸星无色、粘稠、油状的液体,不易挥发酸物理性质有腐蚀性,密度为1.84g/mL浓硫酸的三大特性:吸水性、脱水性(使有机物碳化)、氧化性(遇金属不放出氢气而生成水)浓硫酸的稀释方法:一定把浓硫酸沿器壁慢慢注入水中,并不断搅拌。切不可将水倒入浓硫酸硫酸化学性质:稀硫酸具有酸的通性化学性质:(1)与指示剂的作用:酸溶液能使紫色石蕊试液变红,使酚酞试液不变色(2)酸+活泼金属→盐+氢气如:Zn+2HCl====ZnCl2+H2↑Zn+H2SO4====Zn2SO4+H2↑(3)酸+金属氧化物→盐+水如:CuO+H2SO4====CuSO4+H2OFe2O3+6HCl====2FeCl3+3H2O通性(4)酸+碱→盐+水如:NaOH+HCl====NaCl+H2OCa(OH)2+2HNO3====Cu(NO3)2+2H2O(5)酸+盐→新酸+新盐如CaCO3+2HCl====CaCl2+H20+CO2↑AgNO3+HCl====AgCl↓+HNO3BaCl2+H2SO4====BaSO4↓+2HCl定义:在水溶液中电离时生成的阴离子全部是氢氧根离子的化合物可溶性碱:KOH、NaOH、Ba(OH)2和Ca(OH)2分类不溶性碱:Mg(OH)2、Cu(OH)2、Fe(OH)3等俗称:烧碱、火碱、苛性钠白色固体、极易溶于水(放热)氢氧化钠物理性质易潮解,有强烈的腐蚀性用途:用做某些气体的干燥剂,炉具清洁剂中含有氢氧化钠,去油污等化学性质:具有碱的通性碱常见的碱俗称:熟石灰、消石灰物理性质:白色粉末,微溶于水,其水溶液氢氧化钙俗称石灰水,具有强烈的腐蚀性化学性质:具有碱的通性用途:配制波尔多农药,改良酸性土壤,保护树木(1)与指示剂的作用:碱溶液能使紫色石蕊试液变蓝,使无色酚酞试液变红(2)碱+非金属氧化物→盐+水如:2NaOH+SO2====Na2SO3+H2OCa(OH)2+CO2====CaCO3↓+H20通性(3)碱+酸→盐+水(中和反应)如:2NaOH+H2SO4====Na2SO4+2H2OCa(OH)2+2HCl====CaCl2+2H2O(4)碱+盐→新碱+新盐(可溶)(可溶)(至少有一种物质是沉淀)如:CaCl2+2NaOH====Ca(OH)2↓+2NaClNa2CO3+Ca(OH)2====CaCO3↓+2NaOH中考考点1、酸碱指示剂;2、浓盐酸、浓硫酸的物理性质及浓硫酸的特性和稀释方法;3、酸的性质及用途、碱的性质及用途课时安排本章教学共课时,建议分配如下:知识要点解读及学法指导10.1酸、碱和盐一、酸、碱和盐的组成酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)碱是由金属元素和氢氧根组成的化合物如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)盐是由金属元素元素(或铵根)和酸根组成的化合物如:氯化钠、碳酸钠酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)二、酸1、浓盐酸、浓硫酸的物理性质、特性、用途2、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色(2)金属+酸→盐+氢气(3)碱性氧化物+酸→盐+水(4)碱+酸→盐+水(5)盐+酸→另一种盐+另一种酸(产物符合复分解条件)3、三种离子的检验三、碱1、氢氧化钠、氢氧化钙的物理性质、用途2、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH-)(1)碱溶液与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色(2)酸性氧化物+碱→盐+水(3)酸+碱→盐+水(4)盐+碱→另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)注:①难溶性碱受热易分解(不属于碱的通性)如Cu(OH)2CuO+H2O2Fe(OH)3Fe2O3+3H2O②常见沉淀:AgCl↓、BaSO4↓、Cu(OH)2↓、Fe(OH)3↓、Mg(OH)2↓、BaCO3↓、CaCO3↓③复分解反应的条件:当两种
Ta的资源

2025年湖北省襄阳市枣阳七年级数学上学期期末统考模拟试题含解析

2025年湖北省武汉市汉阳区七年级数学上学期期末达标检测试题含解析

2025年海南省民族中学七年级数学上学期期末复习检测模拟试题含解析

2025年莆田市重点中学七年级数学上学期期末监测模拟试题含解析

2025年甘肃省武威市民勤县七年级数学上学期期末统考试题含解析

2025年浙江省宁波市名校七年级上学期1月期末数学质量检测试题含解析

2025年湖南省涟源市七年级数学上学期期末统考试题含解析

2025年河南省郑州师院附属外语中学数学七上期末检测试题含解析

2025年湖南省怀化市七年级上学期1月期末数学教学质量检测试题含解析

2025年湖北省黄冈市浠水县七年级数学第一学期期中综合测试试题含解析

小寄****淑k
 实名认证
实名认证
 内容提供者
内容提供者
最近下载
最新上传
商务英语BEC考试高级阅读真题.docx
妈妈的礼物作文用户编辑原创.docx
商务英语BEC考试阅读辅导素材.docx
商务英语BEC考试网上报名流程.docx
2025年黑龙江省七台河市勃利县数学七上期末达标测试试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末综合测试试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末质量跟踪监视模拟试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末联考试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末检测模拟试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末经典试题含解析.docx








