
如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
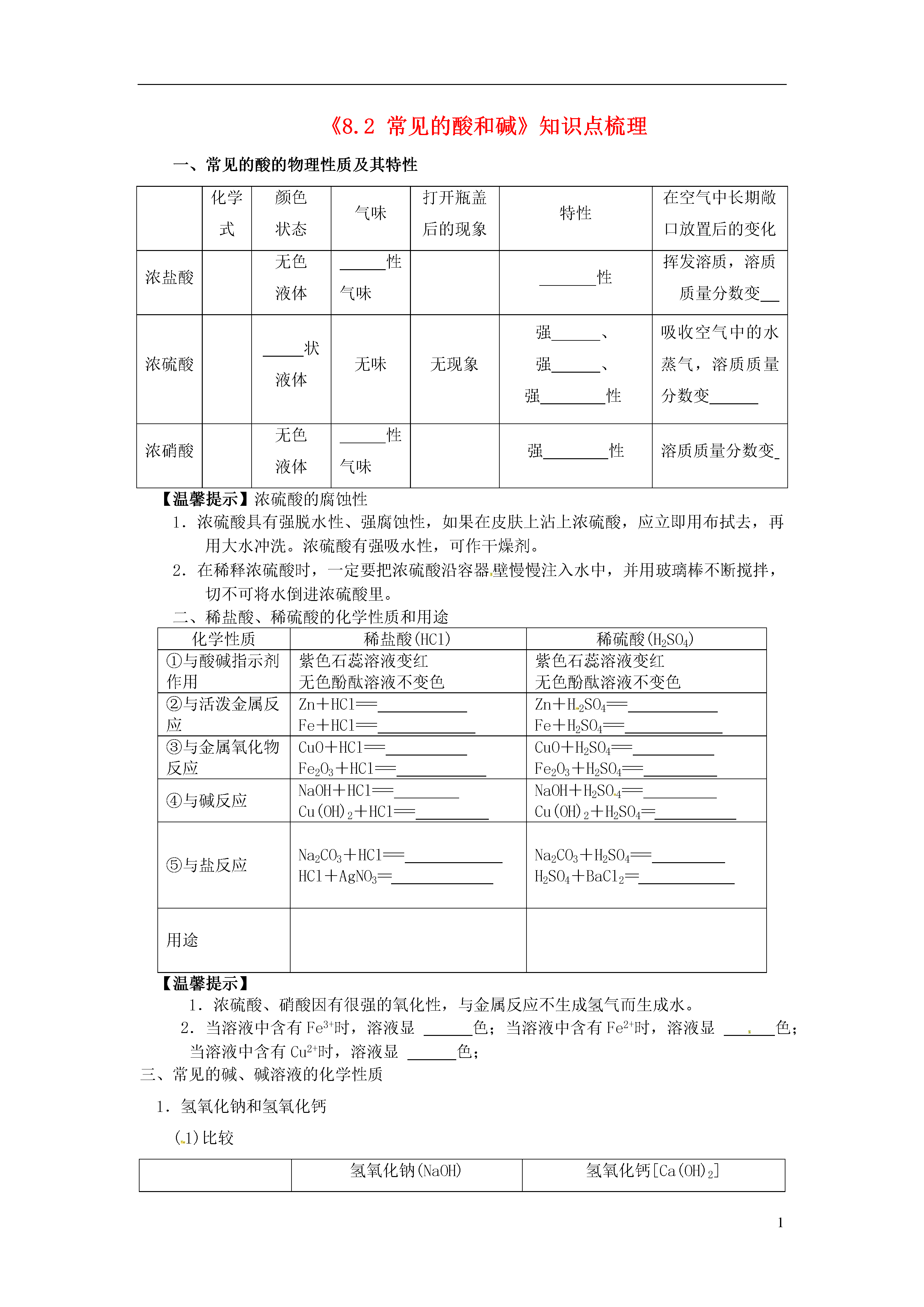
1《8.2常见的酸和碱》知识点梳理一、常见的酸的物理性质及其特性化学式颜色状态气味打开瓶盖后的现象特性在空气中长期敞口放置后的变化浓盐酸无色液体性气味性挥发溶质,溶质质量分数变浓硫酸状液体无味无现象强、强、强性吸收空气中的水蒸气,溶质质量分数变浓硝酸无色液体性气味强性溶质质量分数变【温馨提示】浓硫酸的腐蚀性1.浓硫酸具有强脱水性、强腐蚀性,如果在皮肤上沾上浓硫酸,应立即用布拭去,再用大水冲洗。浓硫酸有强吸水性,可作干燥剂。2.在稀释浓硫酸时,一定要把浓硫酸沿容器壁慢慢注入水中,并用玻璃棒不断搅拌,切不可将水倒进浓硫酸里。二、稀盐酸、稀硫酸的化学性质和用途化学性质稀盐酸(HCl)稀硫酸(H2SO4)①与酸碱指示剂作用紫色石蕊溶液变红无色酚酞溶液不变色紫色石蕊溶液变红无色酚酞溶液不变色②与活泼金属反应Zn+HCl===Fe+HCl===Zn+H2SO4===Fe+H2SO4===③与金属氧化物反应CuO+HCl===Fe2O3+HCl===CuO+H2SO4===Fe2O3+H2SO4===④与碱反应NaOH+HCl===Cu(OH)2+HCl===NaOH+H2SO4===Cu(OH)2+H2SO4==⑤与盐反应Na2CO3+HCl===HCl+AgNO3==Na2CO3+H2SO4===H2SO4+BaCl2==用途【温馨提示】1.浓硫酸、硝酸因有很强的氧化性,与金属反应不生成氢气而生成水。2.当溶液中含有Fe3+时,溶液显色;当溶液中含有Fe2+时,溶液显色;当溶液中含有Cu2+时,溶液显色;三、常见的碱、碱溶液的化学性质1.氢氧化钠和氢氧化钙(1)比较氢氧化钠(NaOH)氢氧化钙[Ca(OH)2]颜色、状态溶解性溶于水,溶解时热溶于水腐蚀性强腐蚀性腐蚀性俗称用途(2)氢氧化钠易吸收空气中的水分而,且能与空气中的发生化学反应而变质,所以氢氧化钠必须保存。利用氢氧化钠易吸水的性质,可使用固体氢氧化钠作。(3)氢氧化钙的制备:①石灰石高温煅烧(方程式)②生石灰与水反应,该反应大量的热。2.NaOH溶液化学性质(1)NaOH溶液使石蕊试液由变,使无色酚酞由变。(2)NaOH+非金属氧化物→盐+H2O例:NaOH+CO2===、NaOH+SO2===(3)NaOH+酸→盐+H2O例:NaOH+HCl===、NaOH+H2SO4===(4)NaOH+盐→新盐+新碱例:CuSO4+NaOH===(现象:)FeCl3+NaOH===(现象:)3.Ca(OH)2溶液的化学性质(1)Ca(OH)2溶液使石蕊试液由变,无色酚酞由变。(2)Ca(OH)2+非金属氧化物→盐+H2O例:Ca(OH)2+CO2===(放在空气中易变质)(3)Ca(OH)2+酸→盐+H2O例:Ca(OH)2+HCl===、Ca(OH)2+H2SO4===(4)Ca(OH)2+盐→新盐+新碱例:Ca(OH)2+CuSO4===、Ca(OH)2+Na2CO3===【思考】1、怎么制取氢氧化钠?2、将生锈的铁钉分别放入盛有稀盐酸和稀硫酸的试管里,过一会将铁钉取出后,观察铁钉表面和溶液变化。现象化学方程式铁锈+盐酸铁锈+硫酸
Ta的资源

2025年辽宁省大连市中学山区七年级数学上学期期末考试模拟试题含解析

2025年贵州省都匀市第六中学七年级数学上学期期末教学质量检测模拟试题含解析

2025年黑龙江大庆市三站中学数学七上期末学业质量监测模拟试题含解析

2025年黑龙江大庆市三站中学七年级上学期1月期末数学学业质量监测试题含解析

2025年重庆市九龙坡区十校七年级数学第一学期期中经典试题含解析

2025年贵州省都匀市第六中学数学七上期末监测模拟试题含解析

2025年贵州省都匀市第六中学数学七上期末联考试题含解析

2025年甘肃省张掖市临泽二中学、三中学、四中学七年级上学期1月期末数学质量跟踪监视模拟试题含解析

2025年海南省白沙县七年级数学上学期期末学业质量监测模拟试题含解析

2025年湖北省荆州市洪湖市七年级数学第一学期期中调研模拟试题含解析

邻家****66
 实名认证
实名认证
 内容提供者
内容提供者
最近下载
最新上传
2025年黑龙江省七台河市勃利县数学七上期末达标测试试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末综合测试试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末质量跟踪监视模拟试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末联考试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末检测模拟试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末经典试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末学业质量监测模拟试题含解析.docx
2025年黑龙江省七台河市勃利县数学七上期末复习检测模拟试题含解析.docx
2025年黑龙江省七台河市勃利县七年级数学第一学期期中达标检测模拟试题含解析.docx
2025年黑龙江省七台河市勃利县七年级数学第一学期期中监测模拟试题含解析.docx








